Những loại Nước thải có thành phần phức tạp, bao gồm nhiều loại chất khác nhau, các loại vi khuẩn, vi sinh vật gây bệnh trong các hoạt động của phòng thí nghiệm, kiểm nghiệm sinh học và hóa học. Do đó không thể xử lý bằng phương pháp sinh học thông thường mà phải sử dụng giải pháp ô xy hóa mạnh. Perozon là giải pháp ô xy hóa nhanh và đơn giản trong khâu vận hành, dễ dàng ứng dụng.
1. YÊU CẦU CHUNG
Công nghệ xử lý đạt chuẩn nước thải đầu ra theo Quy chuẩn Việt Nam về nước thải công nghiệp QCVN40:2011/BTNMT và QCVN 28:2010/BTNMT- Quy chuẩn kỹ thuật Quốc gia về nước thải y tế.
Hệ thống xử lý ổn định, đảm bảo không bị tác động nhiều với các lý do nồng độ nước thải đầu vào
Tuổi thọ công trình đảm bảo từ 10-15 năm vận hành.
Quy trình vận hành đơn giản, không cần có công nhân có kiến thức chuyên môn cao trong quá trình vận hành.
Hệ thống cần thiết kế chế độ chạy tự động, kết hợp với chế độ chạy tay để có thể vừa có thể giảm thiểu sự can thiệp của con người, vừa đảm bảo tính linh động trong quá trình vận hành.
Chi phí vận hành nước thải thấp. Giảm thiểu tối đa các chi phí phát sinh do hỏng hóc, thay thế vật tư.
2 PHƯƠNG ÁN CÔNG NGHỆ
2.1. Đặc điểm thành phần của nước thải:
Nước thải có thành phần rất phức tạp, bao gồm nhiều loại chất khác nhau, các loại vi khuẩn, vi sinh vật gây bệnh trong các hoạt động kiểm nghiệm. Tùy vào từng loại kiểm nghiệm khác nhau mà có thể đưa vào nước thải các thành phần chất thải khác nhau. Do vậy, về cơ bản nước thải của trung tâm có nồng độ các chất ô nhiễm không đồng nhất và kém ổn định.
– Các hóa chất sử dụng trong quá trình thí nghiệm bao gồm
+ Hóa chất dạng rắn (Amoni acetat, Amoni dihydrophosphat, Amoni molipdat, Amoniclorua, Asen, Axit ascorbic, Axit Barbituric, Axit benzoic, Axit boric, Axit Chromo tropic, Axit citric…
+ Hóa chất dạng lỏng: các dung môi hữu cơ như Benzen, Etalnol, Formandehit, n-Hexan, 0-xylen,…
+ Phẩm màu, dung dịch chất chuẩn, chất chuẩn, …
+ Sản phẩm gốc kháng sinh Amoxicillin & Ampicillin, các hợp chất vòng β -Lactam,..
Bảng 1: Nồng độ các chất hữu cơ trong nước thải (tham khảo)
| STT | Tên các chất gây ô nhiễm | Mức lớn nhất (mg/l) | Mức trung bình (mg/l) | Mức nhỏ nhất (mg/l) | Ghi chú |
| 1 | Benzen | 0,12 | 0,02 | 0,004 | |
| 2 | Axetan | 0,15 | 0,03 | 0,013 | |
| 3 | n-Hexan | 0,18 | 0,05 | 0,025 | |
| 4 | Butanol | 0,08 | 0,01 | 0,002 | |
| 5 | Metanol | 0,08 | 0,04 | 0,014 | |
| 6 | Cloroform | 0,07 | 0,02 | 0,015 | |
| 7 | Toluen | 0,05 | 0,01 | 0,002 | |
| 8 | Acetonitril | 0,22 | 0,06 | 0,01 | |
| 9 | Asen (As) | 0, 2 | |||
| 10 | Thủy ngân (Hg) | 0,02 |
Nguồn: Trung tâm Công nghệ xử lý môi trường, 2010 ; Viện Khoa học và Kỹ thuật môi trường, 2009/
2.2.2. Ảnh hưởng của các chỉ tiêu ô nhiễm tới công nghệ xử lý
Nhìn chung, nước thải các phòng thuộc trung tâm có thành phần phức tạp cả về chất và các vi sinh vật gây bệnh, với hàm lượng chất hữu cơ đặc trưng bằng thông số COD tương đối cao. Do vậy người ta thường sử dụng phương pháp ô xy hóa, sử dụng các chất ô xy hóa mạnh để ô xy hóa, phá vỡ cấu trúc các thành phần hữu cơ trong nước thải, tạo thành các chất có thể kết tủa và loại bỏ ra khỏi nước thải.
+ Các hợp chất Beta – Lactam
Trong nước thải của các trung tâm kiểm nghiệm, Beta-lactam (β-lactam) là thành phần đặc trưng. Beta-lactam (β-lactam) là một lactam (amide vòng) với một cấu trúc vòng gồm 3 nguyên tử C và 1 nguyên tử N. Vòng beta-lactam là thành phần của vài loại thuốc kháng sinh như penicillin, vì vậy còn được gọi là thuốc kháng sinh beta-lactam. Các thuốc kháng sinh này tác động ức chế sự tổng hợp màng tế bào vi khuẩn. Chúng có tác động rất mạnh lên vi khuẩn, đặc biệt là vi khuẩn Gram +. Vi khuẩn có thể chống lại thuốc kháng sinh beta-lactam bằng cách sinh ra beta-lactamase. Enzyme này có khả năng mở vòng 4 nguyên tử beta-lactam, làm bất hoạt các tính chất của phân tử kháng khuẩn.
Amoxicillin (C16H19N3O5S) Ampicillin (C16H18N3O4S)
Hiện nay, nước thải ngành dược và y tế có các hợp chất rất khó bị tác động bởi phương pháp xử lý thông thường. Đa số các hợp chất này dễ dàng vượt qua các phương pháp xử lý hóa học và sinh học thông thường. Tuy nhiên, hầu hết các chất hợp chất này có thể được xử lý không khó bởi sự oxi hóa cao cấp (advanced oxidation)
Mục đích của kỹ thuật oxi hóa cao cấp là tạo ra gốc hydroxyl (.OH), một tác nhân oxi hóa mạnh dễ phản ứng, phá hủy hầu hết chất hữu cơ trong nước. Chất dùng để tạo ra gốc hydroxyl (.OH) là hydrogen peroxide (H2O2), H2O2 là chất oxy hóa mạnh, mạnh hơn Cl2, ClO2 và KMnO4. Thông qua các xúc tác như ozon, tia UV, ánh sáng…, H2O2 có thể phân hủy tạo gốc tự do hydroxyl (·OH) có hoạt tính chỉ đứng thứ hai sau Flourine.
Các phản ứng xảy ra như sau:
H2O2 + hν 🡪 2 -OH (với xúc tác tia UV)
H2O2 + O3 🡪 2 -OH + 3O2 (với xúc tác ozon)
H2O2 + Fe2+ 🡪 Fe3+ + OH- + -OH (với xúc tác Fe2+)
Hình 1. Cấu trúc các chất tham gia phản ứng Fenton
Phản ứng với peroxit H2O2 có tham gia của Fe2+ là phản ứng thường dùng và dễ thực hiện nhất.
+ Chất hoạt động bề mặt
Một phân tử chất hoạt động bề mặt gồm 2 phần: phần kỵ nước (không tan trong nước) và phần ưa nước (tan trong nước). Các chất hoạt động bề mặt được chia thành 4 nhóm chính:
– Các chất hoạt động bề mặt anionic: nhóm hữu cơ được liên kết bằng liên kết cộng hóa trị với phần kỵ nước của các chất hoạt động bề mặt mang điện tích âm (-COO-, SO3-, -SO42-). Ví dụ: xà phòng, alkylbenzen sulfonate (ABS)
– Các chất hoạt động bề mặt canionic: nhóm hữu cơ được liên kết bằng liên kết cộng hóa trị với phần kỵ nước của các chất hoạt động bề mặt mang điện tích dương (-NR1R2R3)
– Các chất hoạt động bề mặt không ion (non – ionic surfactant): phần kỵ nước gồm dây chất béo, phần ưa nước chứa những nguyên tử oxy, nitơ hoặc lưu huỳnh không ion hóa: sự hòa tan là do cấu tạo những liên kết hydro giữa các phân tử nước và một số nhóm chức của phần ưa nước, chẳng hạn như nhóm chức ete của nhóm polyoxyetylen (hiện tượng hydrat hóa)
– Các chất hoạt động bề mặt lưỡng tính: những hợp chất có một phân tử tạo nên một ion lưỡng cực
Trong đó các alkylbenzen sulfonate (ABS), mạch nhánh và mạch thẳng, parafin sulfonate, olefin sulfonate, các rượu béo etoxy hóa… đều có đặc điểm chung là mạch hydrocarbon dài, bền vững khó phân hủy sinh học trong điều kiện thông thường
Tác động môi trường của các chất hoạt động bề mặt:
– Cấu trúc của các chất hoạt động bề mặt cho phép làm thay đổi tính chất vật lý bề mặt thuỷ vực thông qua việc làm giảm sức căng bề mặt
– Trong môi trường nước, các chất hoạt động bề mặt tạo thành bọt cản trở quá trình lọc tự nhiên hoặc nhân tạo, tập trung các tạp chất và có khả năng phân tán vi khuẩn và virus
– Làm chậm quá trình chuyển đổi và hoà tan oxy vào nước, ngay cả khi không có bọt, do tạo ra một lớp mỏng ngăn cách sự thấm/ truyền oxy qua bề mặt
– Làm xuất hiện mùi xà phòng, khi hàm lượng cao hơn ngưỡng tạo bọt.
+ Trị số pH
Độ pH cho phép chúng ta xác định nước thải trung tính (pH = 7), tính acid (pH < 7) hay tính kiềm (pH >7). Giá trị pH ảnh hưởng đến các quá trình keo tụ, khử trùng, ảnh hưởng đến sự tồn tại, sinh trưởng và phát triển của các vi sinh vật trong các công trình xử lý sinh học. Quá trình xử lý sinh học nước thải rất nhạy cảm với sự dao động của trị số pH. Quá trình xử lý hiếu khí đòi hỏi trị số pH trong khoảng 6,5 đến 8,5, khoảng giá trị tốt nhất là từ 6,8 đến 7,5.
- Tổng chất rắn hoà tan (TDS)
Là tổng chất rắn hoà tan tồn tại trong nước không thể loại ra bằng màng lọc với bán kính lỗ lọc 0,45 micron. TDS có thể bao gồm các chất khoáng hòa tan muối và axit humic. Trong nước tự nhiên, các thành phần chính của TDS là carbonate, bicarbonate, chloride, sulfate, phosphate, và muối nitrat.
+ Chất rắn lơ lửng (SS)
Là chỉ tiêu cơ bản đánh giá chất lượng nước thải bao gồm cặn lắng được và cặn ở dạng keo không lắng được có thể loại bỏ bằng quá trình keo tụ, lắng, lọc. Hàm lượng chất rắn lơ lửng là chỉ tiêu để thiết kế bể lắng và tính toán lượng cặn dư trong công đoạn xử lý cặn. Lượng cặn làm ảnh hưởng đến các thiết bị xử lý cũng như cản trở sự tiếp xúc giữa các hoá chất, sinh vật xử lý với nước thải làm giảm hiệu quả xử lý
+ Nhu cầu oxy sinh hoá (BOD)
Là lượng oxy cần thiết để vi sinh vật tiêu thụ trong quá trình oxy hoá các chất hữu cơ trong nước thải. Chỉ số BOD là thông số quan trọng để đánh giá mức độ ô nhiễm của nước do các chất hữu cơ có thể bị vi sinh vật phân huỷ. Chỉ số BOD càng cao chứng tỏ lượng chất hữu cơ có khả năng phân huỷ sinh học trong nước càng lớn
+ Nhu cầu oxy hoá học (COD)
Là lượng oxy cần thiết cho quá trình oxy hoá các chất hữu cơ trong nước thành CO2 và H2O. COD là chỉ tiêu rất quan trọng vì nó có thể phản ánh được các chất hữu cơ khó phân huỷ và các chất vô cơ mà chỉ tiêu BOD không phản ánh được vì vậy đây là thông số để xác định lượng oxy cần thiết để oxy hoá tất cả các chất bẩn có trong nước thải.
2.2.3. Nguyên lý hoạt động của hệ thống
Hệ thống xử lý nước thải sử dụng nguyên lý ô xy hóa bậc cao để phá vỡ các hợp chất hữu cơ và vô cơ trong nước thải. Sau đó bằng khâu xử lý hóa học và vật lý tiếp theo với các quá trình keo tụ – lắng, lọc, hấp phụ, các thành phần chất ô nhiễm có trong nước thải được loại bỏ hoàn toàn, nước thải sau khi đi qua hệ thống có các chỉ tiêu hoàn toàn đáp ứng được QCVN 40:2011/BTNMT, QCVN 28:2010/BTNMT- Quy chuẩn kỹ thuật Quốc gia về nước thải y tế để đủ điều kiện xả ra mà không làm ảnh hưởng đến môi trường.
Nguyên tắc chung của quá trình là oxy hóa bậc cao nhờ phản ứng Perozone tức là phản ứng oxy hóa của ozone O3 với sự có mặt của H2O2.
Quá trình Perozone sẽ tạo ra gốc OH- thông qua phản ứng:
H2O2 + 3O3 → 2 .OH + 3O2
Gốc OH- là chất có tính ô-xy hóa khử rất mạnh. Chất này có khả năng khử được trên 90% hàm lượng COD, BOD5 và SS, tiêu diệt trên 95% chỉ số coliform…. Nước thải của máy ozone không phát sinh sản phẩm thứ cấp gây độc hại, đảm bảo tiêu chuẩn để xả ra môi trường.
Ở quá trình này, phản ứng đồng thời của ozon và của các gốc tự do •OH sẽ làm tăng cường tốc độ phân huỷ chất hữu cơ. Paillard (Paillard, H.,1988) đã nghiên cứu xử lý atrazine trong nước sông Sein đã lọc. Kết quả cho thấy rằng hiệu quả xử lý thuốc trừ sâu bằng quá trình kết hợp ozon – hydroperoxide tốt hơn so với quá trình ozon hoá. Tỉ số H2O2/O3 tối ưu là 0,35-0,45.
Hiệu quả quá trình phụ thuộc vào liều lượng ozon, thời gian tiếp xúc và độ kiềm của nước. Hiệu quả xử lý tốt nhất đạt được khi H2O2 được cho thêm vào sau thời điểm phản ứng mạnh của chất với ozon, điều này cho phép tận dụng hết khả năng oxy hóa chọn lọc của phân tử ozon trước khi oxy hoá không chọn lọc bởi .OH.
+ Quá trình xúc tác đồng thể
Quá trình xúc tác đồng thể là quá trình đưa vào hệ O3/H2O2 các chất xúc tác để nâng cao hoạt tính oxy hóa của ozone.
Chất xúc tác kiềm:
Cơ chế tạo gốc tự do hydroxyl .OH trong môi trường nước vói chất xúc tác kiềm OH- như sau:
H2O2 + 3O3 → 2.OH + 3O2 (2)
Chất xúc tác kim loại
Cho vào hệ O3/H2O2 các lon kim loại chuyển tiếp có tác dụng nâng cao hoạt tính oxy hóa của ozone.
Đối với xúc tác sắt Fe2+: Cho vào hệ O3/H2O2 dung dịch FeSO4 sẽ tạo gốc .OH và tạo thànhFe3+. Trong trường họp này Fe2+ là chất tham gia phản ứng và bị tiêu hao trong quá trình phản ứng:
H2O2 + 3O3→ 2 .OH + 3O2 (3)
Đối với xúc tác nhôm Al3+: Cho vào hệ dung dịch phèn nhôm Al(SO4)3. Cơ chế phản ứng có thể như sau: Trong môi trường nước, Al3+ tạo thành Al(OH)3 kết tủa và các bông keo này hấp phụ một phần COD và chất màu trong nước, làm nồng độ COD cao hơn trong nước. Khi có O3 kết hợp với H2O2 sẽ tạo ra gốc .OH và xảy ra phản ứng phân hủy chất hữu cơ trong nước, do trong các bông keo có nồng độ chất hữu cơ rất cao nên tốc độ phản ứng tăng mạnh, giảm nồng độ chất hữu cơ và tiếp tục quá trình hấp phụ chất hữu cơ vào bông keo và quá trình phân hủy COD và màu nước thải tiếp diễn.
+ Quá trình xúc tác dị thể
Quá trình xúc tác dị thể là quá trình đưa vào hệ O3/H2O2 các chất xúc tác rắn là các oxit kim loại chuyển tiếp hoặc than hoạt tính. Theo Legube et al. (1999), cơ chế phản ứng xúc tác dị thể có thể xảy ra theo 2 khả năng sau đây:
– Chất xúc tác chỉ đóng vai trò như một chất hấp phụ Me-OH, ozone và gốc hydroxyl tạo ra từ sự phân huy ozon sẽ là tác nhân oxy hóa.
– Chất xúc tác có thể tác dụng với cả ozon và chất hữu cơ hấp phụ trên bề mặt, đúng nghĩa với bản chất của quá trình xúc tác.
+ Lựa chọn quá trình oxy hóa bậc cao AOPs thích hợp để xử lý nước thải các cơ sở kiểm nghiệm dược phẩm và y tế.
Xử lý nước thải các cơ sở kiểm nghiệm y tế bằng quá trình Perozone (hệ O3/H2O2) có hiệu quả hơn nhiều so với xử lý bằng ozone đơn vì quá trình Perozone hiệu quả tạo ra do tác dụng oxy hóa của gốc .OH và cả O3, trong khi xử lý bằng ozone đơn chỉ có tác dụng oxy hóa của O3.
Với đặc trưng ô nhiễm của nước thải là có độ màu cao và COD khó phân hủy sinh học, độ pH = 7,5 – 9, lựa chọn quá trình AOPs trên cơ sở ozone là Perozone để xử lý nước thải các cơ sở kiểm nghiệm dược phẩm.
2.4. Sơ đồ công nghệ XLNT
Dây chuyền công nghệ xử lý theo sơ đồ nêu trên Hình 2 sau đây.
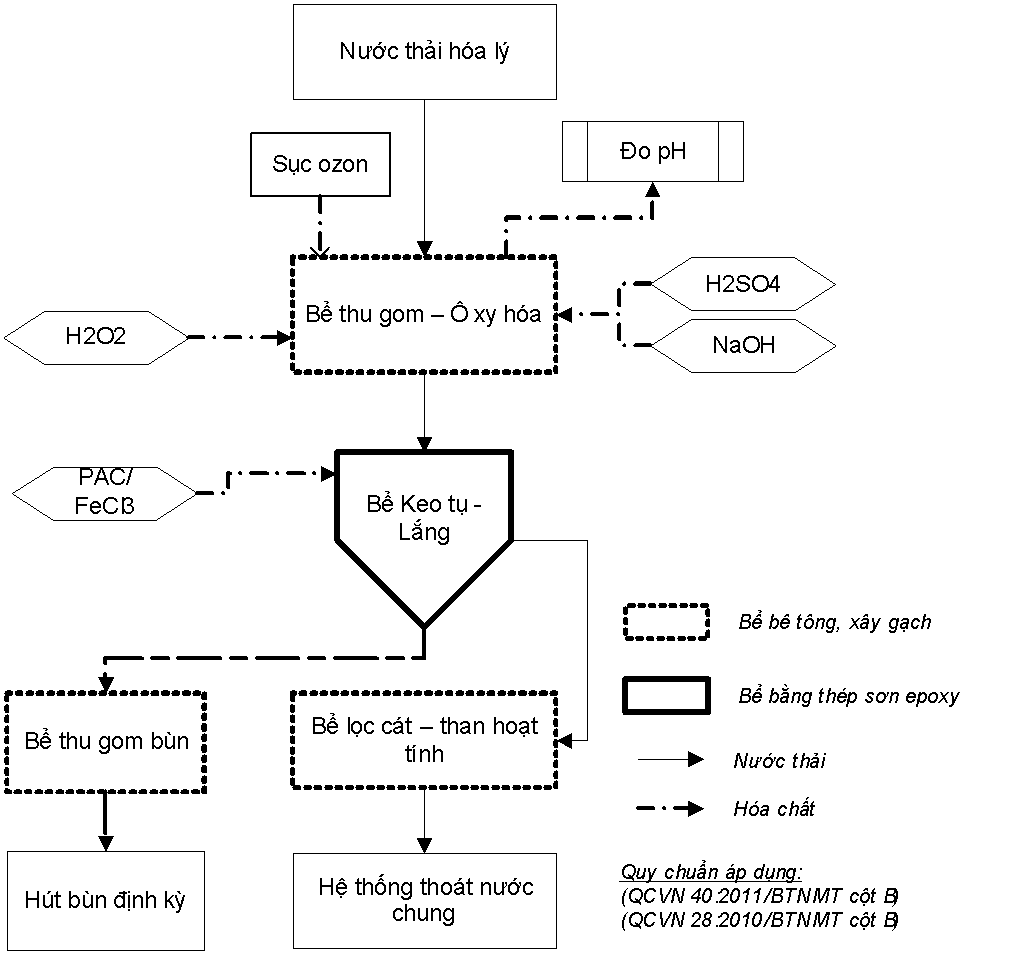
Hình 2. Sơ đồ nguyên lý hệ thống XLNT theo nguyên lý Peroxon
Mô tả:
Nước thải chứa hóa chất được thu gom từ các phòng thí nghiệm bằng hệ thống Lavabo thí nghiệm và đường ống uPVC(xây mới) riêng biệt, không hòa chung với nước thải sinh hoạt. Toàn bộ lượng nước này được gom về bể điều hòa.
Bể điều hòa được thiết kế với dung tích 5m3, trong đó phần dung tích hữu ích là 4m3. Quá trình xử lý gồm 2 giai đoạn là phản ứng ô-xy hóa các chất hữu cơ, vô cơ trong nước thải và quá trình lắng keo tụ các chất này. Kết thúc quá trình là bể lọc cát – than hoạt tính.
2.2.5. Các quy trình xử lý:
+ Phản ứng perozone.
Nguyên lý của hệ thống là sử dụng phản ứng sử dụng tính năng ô-xy hóa mạnh của phân tử OH – được tạo ra từ phản ứng của Ô-zôn và H2O2 . Phân tử OH – sẽ ô xy hóa các chất hữu cơ và vô cơ khó phân hủy, đưa chúng về các dạng hợp chất thấp phân tử dễ xử lý hơn, dễ keo tụ.
Quy trình của phản ứng như sau:
Kiểm tra nồng độ pH bằng thiết bị đo pH để bàn. Khi giá trị này nằm ngoài khoảng 7 – 9 thì bổ sung H2SO4 hoặc NaOH để đưa giá trị pH về khoảng này.
Trước tiên sục đều khí Ô-zôn từ máy tạo ô-zôn. Sau đó cho thêm H2O2 vào với liều lượng tương ứng để tạo ra phản ứng perozone
Hỗn hợp nước thải, peroxit và ozon được trộn đều bằng quá trình khuấy trộn thủy lực trong thời gian 30 phút. Phần lớn các chất hữu cơ có trong nước thải được oxy hóa trong giai đoạn này. Sau đó nước thải được bơm lên bể keo tụ .
+ Phản ứng keo tụ, lắng.
Nước thải được bơm lên bể phản ứng keo tụ kết hợp lắng. Trong bể có máy khuấy để tăng khả năng hòa trộn nước thải vào trong nước. Hóa chất sử dụng là FeCl3.Thời gian phản ứng keo tụ: 20 phút.
Khi hòa FeCl3 vào nước thải sẽ tạo ra phản ứng:
Fe3+ + 3H2O = Fe(OH)3 + 3H+
Phản ứng xảy ra khi pH > 3.5
Hình thành lắng nhanh khi pH =5.5 – 6.5
Trong trường hợp dùng PAC (PolyAluminiumChloride), Al3+ của PAC tạo thành Al(OH)3 kết tủa và các bông keo này hấp phụ một phần COD và chất màu trong nước, làm nồng độ COD cao hơn trong nước. Tuy nhiên điều kiện để dùng PAC keo tụ là pH>6,5.
Vận tốc nước trong vùng lắng v<0.02m/s đảm bảo cho hạt cặn được lắng xuống dưới. Bùn cặn lắng về phần côn thu của bể lắng và được xả về bể chứa bùn. Bùn cặn lắng sẽ được lắng trọng lực, phần cặn lắng sẽ bị nèn xuống dưới, phần nước trong sẽ ở trên. Sau thời gian định kỳ từ 3 – 6 tháng bùn sẽ được hút.
Bể lọc cát – than hoạt tính
Đây là khâu làm sạch triệt để nước thải trước khi thải ra môi trường ngoài, đảm bảo các yêu cầu trong QCVN 40:2011/BTNMT cột B. QCVN 28:2010/BTNMT- Quy chuẩn kỹ thuật Quốc gia về nước thải y tế.
Bể lọc có cấu tạo 2 lớp, lớp trên là cát thô, đường kính từ 0,8-1,2mm, dày 30cm. Lớp dưới than hoạt tính dày 30cm.
Chức năng của bể: giữ lại các chất lơ lửng (TSS) còn lại sau quá trình lắng, làm trong nước nhờ lớp lọc cát. Lớp than hoạt tính có tác dụng hấp phụ giữ lại các chất hữu cơ còn lại trước khi xả nước thải ra ngoài



















