CHƯƠNG 1:TỔNG QUAN
1.1. Tổng quan về phèn nhôm
1.1.1. Giới thiệu chung về phèn nhôm [6,7]
Nhôm sunfat sản xuất từ acid sunfuric và một số vật liệu chứa nhôm như đất sét, cao lanh, quặng bôxit, nhôm hydroxit. Có công thức chung là Al2(SO4)3.nH2O. Phèn nhôm là một loại muối có công thức chung là M2SO4.Al(SO4)3.xH2O ( M có thể là ion kim loại kiềm hoặc ion amoni).
Nếu chỉ có nhôm sunfat thì là phèn đơn và khi cho thêm kali sunfat hoặc amoni sunfat thì gọi là phèn kép. Để điều chế sản phẩm này người ta cho nhôm sunfat với muối sunfat của kim lại kiềm hoặc amoni theo tỉ lệ mol tương ứng sau đó cô đến tạo váng rồi kết tinh. Khi cho thêm kali sunfat vào quá trình phản ứng, thu được nhôm kali sunfat công thức phân tử là K2SO4.Al2(SO4)3.24H2O hay AlK(SO4)2.12H2O. Trường hợp dùng amoni sunfat thu được phèn nhôm amoni có công thức phân tử là Al2(SO4)3.(NH4)2SO4.24H2O hay Al(NH4)(SO4)2.12H2O.
Đó là những phèn nhôm tồn tại ở dạng đơn phân tử ngoài ra còn có loại phèn nhôm tồn tại ở dạng cao phân tử (polyme) như những phèn sau: PAC, WAC, PASC, PASS. Phèn PAC hay còn gọi poly aluminum chlorite có công thức phân tử chung là (Aln(OH)mCl(3n-m)) với m= 4-10, n= 2-5. Ta có thể coi những chất poly aluminum chlorite (PAC) như là sản phẩm tạo thành bởi phản ứng không triệt để giữa axit clohydric và nhôm hydroxit theo phương trình:
![]()
Tương tự, trong công thức phân tử Aln(OH)m(SO4)kCl3n-m-2k của chất poly aluminum cloro sunfat (WAC) có một số ion Cl bị thay thế bởi những gốc hydroxyl OH và những gốc sunfat SO4-. Còn trong công thức phân tử của những chất poly aluminum clorua silicat (PACS) và poly aluminum sillcate sulphate (PASS) lại chứa những gốc silicat SiO3- hay những nhóm silic oxit SiO2.
1.1.2. Phân loại phèn nhôm
Phèn nhôm gồm hai dạng
– Dạng đơn phân tử
Phèn nhôm đơn: có công thức chung của nhôm sunfat là Al2(SO4)3.nH2O, thường gặp Al2(SO4)3.18H2O chứa 15% Al2O3. Tùy theo điều kiện sản xuất, có thể thu được nhiều loại tinh thể nhôm sunfat hydrat hóa khác nhau trong đó giá trị của n có thể là 18, 16, 27,…
Phèn nhôm kép: là muối kép của nhôm sunfat với sunfat kim loại kiềm hoặc amoni. Ví dụ như phèn K2SO4.Al2(SO4)3.24H2O, …
Kali nhôm sunfat hay (thường gọi là phèn chua) K2SO4.Al2(SO4)3.24H2O là những tinh thể lớn hình bát diện, trong suốt, không màu, vị chát, cảm giác se lưỡi, khối lượng riêng d =1,75 g/cm3, nhiệt độ nóng chảy 92oC, đun nóng đến 200oC thì mất nước kết tinh thành phèn khan ở dạng bột trắng, ít tan trong nước.
Dung dịch phèn có tính acid, không độc. Tinh thể phèn tan trong nước tạo màng hydroxit lắng xuống kéo theo các chất bẩn lơ lửng trong nước. Vì vậy nó được dùng làm trong nước, làm chất keo tụ trong xử lý nước, làm chất cầm màu trong nhuộm vải, chất kết dính trong ngành sản xuất giấy, làm thuốc thử trong các phòng thí nghiệm, dùng làm thuốc cầm máu, lau rửa bộ phận cơ thể ra nhiều mồ hôi, rửa niêm mạc miệng, họng, làm thuốc rắc kẽ chân.
– Dạng cao phân tử: là loại phèn nhôm tồn tại ở dạng (polyme) ví dụ như phèn poly aluminum chlorite (PAC), … Chứa 30- 31% Al2O3
Phèn poly aluminum chlorite (PAC) có PAC rắn và PAC dạng lỏng. Dạng rắn là bột màu vàng và dạng lỏng có màu nâu vàng tan tốt trong nước. Có công thức (Aln(OH)mCl(3n-m)) thường gặp nhất khi m=3 và n=2 công thức phân tử là (Al2(OH)3Cl3)
Trong bài đồ án này sử dụng phèn kali nhôm sunfat có công thức phân tử là: K2SO4.Al2(SO4)3.24H2O và phèn poly aluminum chlorite (PAC) có công thức (Al2(OH)3Cl3).
1.1.3. Đặc tính của phèn nhôm
Làm chất keo tụ trong xử lý nước thải, thực hiện phản ứng thủy phân với nước tạo thành các bông hydroxit kim loại có khả năng hút các hạt lơ lửng trong nước rơi theo lực trọng trường, lắng nhanh xuống đáy. Quá trình keo tụ diễn ra do phản ứng thủy phân của muối như sau:
![]()
Theo phản ứng trên, hydroxit nhôm keo tụ lôi kéo các chất lơ lửng kết tủa. Trong công nghệ xử lí nước (và ở mức độ nhất định công nghệ xử lí nước thải và một số công nghệ khác) công nghệ keo tụ mà theo truyền thống chất keo tụ là phèn nhôm Al2(SO4)3 đóng vai trò quan trọng.
Vai trò của phèn nhôm là khi được đưa vào nước cần xử lí chứa cặn lơ lửng, đầu tiên nó phải hòa tan tạo Al3+ để trung hoà điện tích các hạt keo âm, sau đó muối nhôm thủy phân tạo bông cặn là Al(OH)3. Trong bể lắng, bông cặn kết tủa kéo theo cặn lơ lửng cần xử lí và làm trong nước. Trong thực tế phèn cũng thực hiện cả cách tạo bông nếu thiết kế khu vực tạo bông tốt sẽ tạo điều kiện cho các bông cặn nhỏ tiếp xúc để tạo các bông lớn. Công đoạn keo tụ làm trong nước là một bước kĩ thuật quan trọng trong dây chuyền công nghệ xử lý nước thải và các loại nước có nhiều cặn lơ lửng khác.
1.2. Tổng quan về nước thải ngành công nghệ dệt nhuộm
1.2.1. Quy trình công nghệ
Ngành dệt nhuộm là ngành công nghiệp có dây chuyền công nghệ sản xuất phức tạp, áp dụng nhiều loại hình công nghệ khác nhau. Tùy theo quy mô của cơ sở dệt nhuộm, tính chất của nguồn nguyên liệu, tính chất của sản phẩm, trình độ công nghệ mà các công đoạn dệt nhuộm tại các cơ sở cũng khác nhau nhiều hay ít. Quy trình công nghệ dệt nhuộm được trình bày như sau:
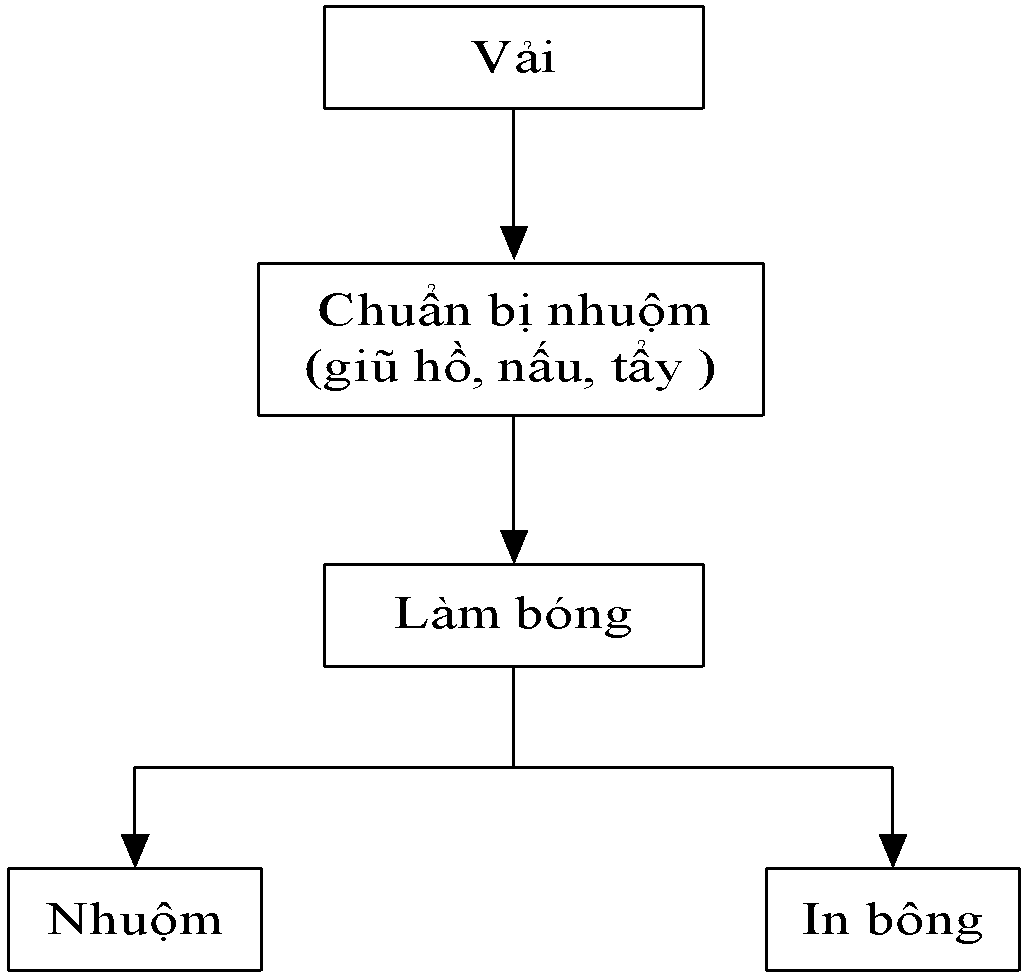
Hình 1.1. Sơ đồ chung quy trình công nghệ dệt nhuộm [1]
1.2.2. Các nguồn ô nhiễm, đặc tính dòng nước thải ngành dệt nhuộm [1]
Các chất gây ô nhiễm chính trong nước thải của công ngành dệt nhuộm gồm:
Các tạp chất tách ra từ vải sợi như dầu mỡ, các hợp chất chứa nitơ, các chất bụi bẩn dính vào sợi (trung bình 6% khối lượng xơ sợi).
Các hóa chất sử dụng trong quá trình công nghệ dệt nhuộm như hồ tinh bột, H2SO4, CH3COOH, NaOH, NaOCl, H2O2…Các loại thuốc nhuộm, các chất trợ ngấm, chất cầm màu, chất tẩy giặt. Lượng hóa chất sử dụng đối với từng loại vải, từng loại màu thường khác nhau và chủ yếu đi vào nước thải của từng công đoạn tương ứng.
Dệt nhuộm là một trong những ngành đòi hỏi sử dụng nhiều đến nước và hóa chất. Hiện nay trong ngành công nghiệp dệt nhuộm dùng rất nhiều nước để phục vụ cho các công đoạn sản xuất bình quân 50-300m3/ tấn sản phẩm. Trong đó nguồn ô nhiễm chính xuất phát từ công đoạn dệt nhuộm và nấu tẩy.
Hàng năm, ngành công nghiệp dệt nhuộm sử dụng hàng nghìn tấn thuốc nhuộm. Hiệu suất sử dụng cúa các loại thuốc nhuộm vào khoảng 70-80% và tối đa là 95%. Tùy theo từng loại vải, loại sản phẩm mà người ta có thể sử dụng nhiều loại thuốc nhuộm thích hợp như thuốc nhuộm hoàn nguyên, thuốc nhuộm hoạt tính, thuốc nhuộm phân tán. Với mỗi loại thuốc nhuộm ở môi trường khác nhau thì tính chất nước thải cũng khác nhau.
Đặc trưng quan trọng nhất của nước thải từ các cơ sở dệt nhuộm là sự dao động rất lớn về lưu lượng và tải trọng các chất ô nhiễm, nó thay đổi theo mùa theo mặt hàng sản xuất và chất lượng sản phẩm.
Thành phần nước thải của công nghệ dệt nhuộm rất đa dạng bao gồm các chất ô nhiễm dạng hữu cơ và dạng vô cơ. Nhìn chung nước thải từ các cơ sở dệt nhuộm có độ kiềm khá cao, có độ màu và hàm lượng các chất hữu cơ COD cao
Nước thải tẩy dệt: có pH từ 9-12, hàm lượng chất hữu cơ COD từ 1000-3000 mg/l do thành phần chất tẩy gây nên. Độ màu của nước ở giai đoạn đầu có thể lên đến 10000 Pt-Co, hàm lượng cặn lơ lửng khoảng 200mg/l nồng độ này giảm ở những giai đoạn cuối. Thành phần của nước thải gồm thuốc nhuộm thừa, chất hoạt động bề mặt, các chất oxy hóa cellulose, xút, chất điện ly …
Nước thải nhuộm thường không ổn định và đa dạng, do hiệu quả hấp thụ thuốc nhuộm của vải chỉ đạt 60-70%, và 30-40% các phẩm nhuộm thừa ở dạng nguyên thủy hoặc bị phân hủy ở một dạng khác. Ngoài ra một số các chất điện ly, chất hoạt động bề mặt, chất tạo môi trường cùng tồn tại đã gây ra độ màu rất cao của nước thải nhuộm.
Thành phần nước thải dệt nhuộm thường chứa các gốc như RSO3Na, RSO3-, N-OH, R-NH2 … Do các phẩm nhuộm hoạt tính, hoàn nguyên, và lượng phẩm nhuộm thừa lớn dẫn đến gia tăng chất hữu cơ và độ màu làm nước có độ màu rất cao đôi khi lên đến 50.000 Pt-Co, hàm lượng COD thay đổi từ 80 đến 18.000 mg/l, pH của nước thay đổi từ 2-14.
Mức độ ô nhiễm của nước thải dệt nhuộm phụ thuộc rất lớn vào loại và lượng hóa chất sử dụng, vào kết cấu mặt hàng sản xuất (tẩy trắng, nhuộm, in hoa…), vào tỷ lệ sử dụng sợi tổng hợp, vào loại hình công nghệ sản xuất (gián đoạn, liên tục hay bán liên tục), vào đặc tính máy móc thiết bị sử dụng…
Bảng1.1. Các chất gây ô nhiễm và đặc tính của nước thải ngành dệt nhuộm [1]
| Công đoạn | Chất gây ô nhiễm trong nước thải | Đặc tính dòng thải |
| Hồ sợi, giũ hồ | Tinh bột, glucozo, cacboxy metyl, cellulozo, polyvinyl alcol, nhựa, chất béo và sáp | BOD cao (34 – 50% tổng lượng BOD) |
| Nấu tẩy | NaOH, chất sáp và dầu mỡ, tro, soda, silicat natri và xơ sợivụn | Độ kiềm cao, màu tối, BOD cao (30% tổng BOD) |
| Tẩy trắng | Hypoclorit, hợp chất chứa clo, NaOH, AOX, axit… | Độ kiềm cao, chiếm 5% BOD |
| Làm bóng | NaOH tạp chất | Độ kiềm cao, BOD thấp (dưới 1% tổng BOD) |
| Nhuộm | Các loại thuốc nhuộm, acid axetic và các muối kim loại | Độ màu rất cao, BOD khá cao (6% tổng BOD), TS cao |
| In | Chất màu, tinh bột, dầu, đất sét, muối kim loại và acid | Độ màu cao, BOD cao và dầu mỡ |
| Hoàn thiện | Vết tinh bột, mỡ động vật, muối | Kiềm nhẹ, BOD thấp, lượng nhỏ |
1.2.3. Các loại thuốc nhuộm thường dùng trong ngành dệt nhuộm [2]
Thuốc nhuộm phân tán
Nhóm thuốc nhuộm này có cấu tạo phân tử từ gốc azo và antraquinon và nhóm amin (NH2, NHR, NR2, NR-OH), dùng chủ yếu để nhuộm các loại sợi tổng hợp (sợi axetat, sợi polieste…) không ưa nước.
Thuốc nhuộm acid
Là các muối sunfonat của các hợp chất hữu cơ khác nhau có công thức là R-SO3Na khi tan trong nước phân ly thành nhóm R-SO3 mang màu. Các thuốc nhuộm này thuộc nhóm mono, diazo và các dẫn xuất của antraquinon, triaryl metan…
Thuốc nhuộm hoạt tính
Là những hợp chất màu mà trong phân tử của chúng có chứa các nhóm nguyên tử có thể thực hiện mối liên kết hóa trị với vật liệu nói chung và xơ dệt nói riêng trong quá trình nhuộm. Thuốc nhuộm hoạt tính có đủ gam màu, màu tươi và thuần sắc, công nghệ nhuộm đa dạng và không quá phức tạp. Chúng được sử dụng để nhuộm và in hoa cho các vật liệu cellulozo, tơ tằm, len, vật liệu từ xơ polyamit.
Các loại thuốc nhuộm hoạt tính tuy có khác nhau về cấu tạo phân tử, phạm vi sử dụng và hoạt độ có thể trình bày dưới dạng tổng quát:
![]()
Trong đó:
S- nhóm tạo cho phân tử có độ hòa tan cần thiết trong nước, thường gặp hơn cả là các nhóm: – SO3Na, – COONa, – SO2CH3.
R- phần mang màu của phân tử thuốc nhuộm nó không ảnh hưởng đến mối liên hệ giữa thuốc nhuộm và xơ mà nó quyết định về màu sắc, về độ bền màu với ánh sáng và cũng có tác động đến các chỉ tiêu về độ bền màu khác, nên việc chọn gốc R phải thỏa mãn được các yêu cầu kể trên. Những gốc màu được chọn vào mục đích này là: mono và điazo, phức chất của thuốc nhuộm azo với ion kim loại, gốc thuốc nhuộm acid antraquinon, hoàn nguyên đa vòng, dẫn xuất của Ftaloxianin…
T-X- nhóm hoạt tính có cấu tạo khác nhau, được đưa vào các hệ thống mang màu khác nhau.
X- nguyên tử hay nhóm phản ứng, trong điều kiện nhuộm nó sẽ tách khỏi phân tử thuốc nhuộm, tạo khả năng cho thuốc nhuộm thực hiện phản ứng hóa học với xơ. X không ảnh hưởng gì đến màu sắc nhưng đôi khi cũng có ảnh huởng đến độ hoà tan của thuốc nhuộm. Những nguyên tử này thường là: -Cl, -SO2, -OSO3H, -NR3, -CH=CH2…
T- nhóm mang nguyên tử (hay nhóm) phản ứng, nó làm nhiệm vụ liên kết giữa thuốc nhuộm với xơ và có ảnh hưởng quyết định đến độ bền liên kết này, trước hết là độ bền màu của thuốc nhuộm với gia công ướt. Không những thế, hầu hết các trường hợp sự tương tác của thuốc nhuộm hoạt tính với xơ là phản ứng nucleophin, nhóm T sẽ đóng vai trò quyết định tốc độ phản ứng nên việc lựa chọn nhóm T cho phù hợp rất quan trọng.
Những ưu điểm và nhược điểm của thuốc nhuộm hoạt tính:
– Ưu điểm: có gam màu rộng, màu tươi và thuần sắc, có độ bền cao với gia công ướt, dễ làm sạch nước thải, giá thành vừa phải.
– Nhược điểm: khó giặt sạch phần thuốc nhuộm bị thủy phân, tốn nhiều hóa chất, độ bền màu với ánh sáng không cao nhất là màu đỏ và màu cam.
Thuốc nhuộm trực tiếp
Đây là thuốc nhuộm bắt màu trực tiếp với xơ sợi không qua giai đoạn xử lý trung gian, thường sử dụng để nhuộm sợi 100% cotton, sợi protein (tơ tằm) và sợi poliamid, phần lớn thuốc nhuộm trực tiếp có chứa azo và một số là dẫn xuất của dioxazin. Ngoài ra, trong thuốc nhuộm còn có chứa các nhóm làm tăng độ bắt màu như triazin và salicylic acid có thể tạo phức với các kim loại để tăng độ bền màu.
Thuốc nhuộm hoàn nguyên
Thuốc nhuộm hoàn nguyên gồm hai nhóm chính: nhóm đa vòng có chứa nhân antraquinon và nhóm indigoit có chứa nhân indigo. Công thức tổng quát là R=C-O, trong đó R là hợp chất hữu cơ nhân thơm, đa vòng. Các nhân thơm đa vòng trong loại thuốc nhuộm này cũng là tác nhân gây ung thư, vì vậy khi không được xử lý, thải ra môi trường, có thể ảnh hưởng đến sức khỏe con người.
Thuốc nhuộm lưu huỳnh
Là nhóm thuốc nhuộm chứa mạch dị hình như tiazol, tiazin, zin… trong đó có cầu nối -S-S- dùng để nhuộm các loại sợi cotton và viscose.
Thuốc in, nhuộm pigmen
Có chứa nhóm azo, hoàn nguyên đa vòng ftaoxianin, dẫn xuất của antraumon.
1.3. Các chỉ tiêu đánh giá chất lượng nước [4]
1.3.1. Các chỉ tiêu vật lý
1.3.1.1. Độ đục
Nước tinh khiết trong suốt không màu, có khả năng cho ánh sáng truyền qua. Khi có các tạp chất huyền phù, cặn rắn lơ lửng, các vi sinh vật và cả các hóa chất hòa tan thì khả năng truyền ánh sáng của nước giảm đi.
Dựa vào đó người ta xác định độ đục của nước. Nước có độ đục cao tức là có nhiều tạp chất chứa trong đó và do vậy khả năng truyền ánh sáng qua nước giảm. Đơn vị đo độ đục thường dùng là mg SiO2/l, NTU, FTU, trong đó đơn vị NTU và FTU là tương đương nhau.
1.3.1.2. Độ màu
Nước nguyên chất không có màu, khi nước chứa một số các chất hòa tan thì nó trở nên có màu, các hợp chất sắt hòa tan làm cho nước có màu nâu đỏ, các chất mùn humic làm cho nước có màu vàng, các loài thủy sinh tạo cho nước có màu xanh lá cây… Nước thải sinh hoạt và nước thải công nghiệp thường tạo ra màu xám hoặc màu đen cho nguồn nước.
Đơn vị đo độ màu thường dùng là độ theo thang màu platin – Coban. Nước thiên nhiên thường có độ màu thấp hơn 200 độ (Pt – Co). Độ màu biểu kiến trong nước do các tạp chất lơ lửng trong nước tạo ra và dễ dàng loại bỏ bằng phương pháp lọc. Trong khi đó, để loại bỏ màu thực của nước (do các chất hòa tan tạo ra) phải dùng các biện pháp hóa lý kết hợp.
1.3.1.3. Hàm lượng chất thải rắn trong nước
Hàm lượng chất rắn trong nước gồm có chất rắn vô cơ (các muối hòa tan, chất rắn không hòa tan như huyền phù, đất cát…), chất rắn hữu cơ (gồm các vi sinh vật, vi khuẩn, động vật nguyên sinh, tảo và các chất vô cơ rắn hữu cơ vô sinh như phân, rác, chất thải công nghiệp…). Trong xử lý nước người ta đưa ra các khái niệm sau:
– Tổng hàm lượng cặn lơ lửng TSS là trọng lượng khô tính bằng miligam của phần còn lại sau khi bay hơi 1 lít mẫu nước trên nồi cách thủy rồi sấy khô ở 103oC tới khi có trọng lượng không đổi, đơn vị là mg/l.
– Cặn lơ lửng SS là phần trọng lượng khô tính bằng miligam của phần còn lại trên giấy lọc khi lọc 2 lít mẫu nước qua phễu, sấy khô ở 103oC-105oC tới khi có trọng lượng không đổi, đơn vị là mg/l.
– Chất rắn hòa tan DS bằng hiệu giữa tổng hàm lượng cặn lơ lửng TSS và cặn lơ lửng SS:
DS = TSS – SS
– Chất rắn bay hơi VS là phần mất đi khi nung ở 550oC trong một thời gian nhất định. Phần mất đi là chất rắn bay hơi, phần còn lại là chất rắn không bay hơi.
1.3.2. Các chỉ tiêu hóa học
1.3.2.1. Hàm lượng oxy hòa tan DO
Một trong những chỉ tiêu quan trọng nhất của nước là hàm lượng oxy hòa tan, vì không thể thiếu được đối với tất cả các vi sinh vật sống trên cạn cũng như dưới nước.
Oxy là chất khí khó hòa tan trong nước, không tác dụng với nước về mặt hóa học. Độ hòa tan của nó phụ thuộc vào áp suất, nhiệt độ và các đặc tính của nước (các thành phần hóa học, vi sinh, thủy sinh sống trong nước…). Nồng độ của nó khoảng 8÷15mg/l ở nhiệt độ bình thường. Để xác định hàm lượng oxy hòa tan trong nước nguồn cũng như nước thải, người ta thường dùng phương pháp iot (hay còn gọi là phương pháp Winkler).
1.3.2.2. Nhu cầu oxy sinh học BOD
Nhu cầu sinh hóa oxy BOD là lượng oxy cần thiết để vi sinh vật phân hủy các chất hữu cơ trong một đơn vị thể tích nước nhất định (1000 ml) trong một đơn vị thời gian nhất định, trong điều kiện nhiệt độ là 20oC và không có ánh sáng.
Để xác định lượng oxy đó cần phải cung cấp cho nước thải một lượng oxy thừa đủ cho quá trình phân hủy các chất hữu cơ do các vi sinh vật (quá trình đó có thể là: 5, 10, 15, 20 ngày tùy theo yêu cầu nghiên cứu).
Lượng oxy trong nước giảm đi so với ngày đầu cho biết số mg oxy mà các vi sinh vật đã tiêu thụ. Trong môi trường nước, khi quá trình oxy hóa sinh học xảy ra thì các vi khuẩn sử dụng oxy hòa tan.
Vận tốc của quá trình oxy hóa nói trên phụ thuộc vào số vi khuẩn có trong nước và nhiệt độ của nước. BOD cũng là một chỉ tiêu dùng để đánh giá mức độ nhiễm bẩn của nước.
BOD có thể được xác định bằng phương pháp hóa học khi sử dụng kali permaganat, xanh metylen, xác định từ COD. Hoặc cũng có thể dùng phương pháp sinh học, dùng chai BOD hay phương pháp hô hấp.
Vì quá trình oxy hóa hoàn toàn các hợp chất hữu cơ đòi hỏi phải tốn nhiều thời gian nên người ta thường dùng chỉ tiêu BOD5 là lượng oxy tiêu thụ sau 5 ngày.
1.3.2.3. Nhu cầu oxy hóa học COD
COD là lượng oxy cần thiết để oxy hóa hết các hợp chất hữu cơ có trong nước, tạo thành CO2 và H2O. COD là một đại lượng dùng để đánh giá sơ bộ mức độ ô nhiễm của nguồn nước. Phương pháp phổ biến nhất để xác định COD là phương pháp kali bicromat.
1.3.2.4. Độ pH
Độ pH là đại lượng được định nghĩa theo phương trình sau:
![]()
Tính chất của nước được xác định theo các giá trị khác nhau của pH:
– Khi pH = 7 nước có môi trường trung tính
– Khi pH > 7 nước có tính kiềm
– Khi pH < 7 nước có tính acid.
pH có thể xác định bằng giấy quỳ hoặc bằng các máy đo pH (pH mét) điện cực hydro hoặc cực thủy tinh.
1.4. Phương pháp xử lý nước thải dệt nhuộm [4]
Quá trình xử lý nước thải là một quy trình công nghệ bao gồm nhiều công đoạn nhỏ, mỗi công đoạn chỉ có thể xử lý được một phần tạp chất nhất định. Do đó chúng ta phải tìm hiểu sơ bộ về các công đoạn và phương pháp xử lý trong một dây chuyền cơ bản.
Do đặc thù của công nghệ, nước thải ngành dệt nhuộm chứa tổng hàm lượng chất rắn lơ lửng, độ màu, BOD, COD cao. Các yếu tố được cân nhắc khi lựa chọn phương án xử lý thích hợp cho nước thải dệt nhuộm là hiệu quả xử lý, hiệu quả kinh tế, tính chất và lưu lượng nước thải, thành phần và nồng độ các chất ô nhiễm có trong nước thải, đặc biệt phương pháp xử lý phải phù hợp với điều kiện sản xuất.
Có rất nhiều phương pháp để xử lý nước thải như phương pháp hóa học (phương pháp oxy hóa khử…), phương pháp cơ học (lắng lọc…), phương pháp sinh học, phương pháp hóa lý gồm đông tụ và keo tụ, hấp phụ, tuyển nổi… Trong bài đồ án này chúng em đã chọn phương pháp hóa lý keo tụ-tạo bông.
1.4.1. Phương pháp keo tụ – tạo bông
Các tạp chất trong nước thường đa dạng về chủng loại và kích thước, chúng có thể là các hạt cát, sinh vật phù du, sản phẩm hữu cơ phân hủy như thuốc nhuộm… Kích thước hạt dao động từ vài phần triệu milimet đến vài milimet. Bằng các phương pháp xử lý cơ học như lắng lọc, tuyển nổi, chỉ có thể loại bỏ được các hạt có kích thước lớn hơn 10-4 mm, với các hạt có kích thước nhỏ hơn 10-4 mm, nếu dùng quá trình lắng tĩnh thì phải tốn rất nhiều thời gian và cũng rất khó có thể có được hiểu quả cao, do vậy cần phải áp dụng phương pháp xử lý hóa lý, đó là phương pháp keo tụ.
Keo tụ là phương pháp xử lý nước có sử dụng hóa chất, trong đó các chất rắn gây đục dạng hạt keo nhỏ lơ lửng trong nước nhờ tác dụng của chất keo tụ mà liên kết với nhau tạo thành bông keo có kích thước lớn hơn dễ lắng.
Các chất keo tụ thường được sử dụng là phèn nhôm, phèn sắt…dưới dạng dung dịch hòa tan, các chất điện ly hoặc các chất cao phân tử…
Cấu tạo của hạt keo
Tùy thuộc vào nguồn gốc xuất xứ, thông thường các hạt cặn trong nước đều có thể mang điện tích âm hoặc dương, ví dụ hạt cặn gốc silic, các tạp chất hữu cơ đều mang điện tích âm. Các hydroxit nhôm, sắt mang điện tích dương. Khi thế cân bằng điện động của nước bị phá vỡ các thành phần mang điện tích sẽ kết dính với nhau nhờ lực liên kết phân tử và lực điện từ, tạo thành một tổ hợp các phân tử, nguyên tử hoặc các ion tự do. Các tổ hợp tạo thành được gọi là hạt keo. Tùy thuộc vào thành phần cấu tạo các hạt keo sẽ có những tính chất khác nhau. Người ta có thể chia các hạt keo thành hai loại: keo kỵ nước và keo háo nước. Trong kỹ thuật xử lý nước bằng quá trình keo tụ, keo kỵ nước đóng vai trò chủ đạo.
Hạt keo có cấu tạo rất phức tạp gồm:
– Nhân keo: là tập hợp có thể bằng hàng trăm hoặc hàng ngàn tùy thuộc vào độ phân tán, kích thước nguyên tử hay phân tử.
– Lớp hấp phụ: được tạo ra do nhân keo có khả năng hấp phụ mạnh và hấp phụ chọn lọc những ion có trong thành phần nhân hạt keo.
– Lớp khuyết tán: tạo ra do các hạt keo còn hút những ion ngược dấu ở xa hơn.
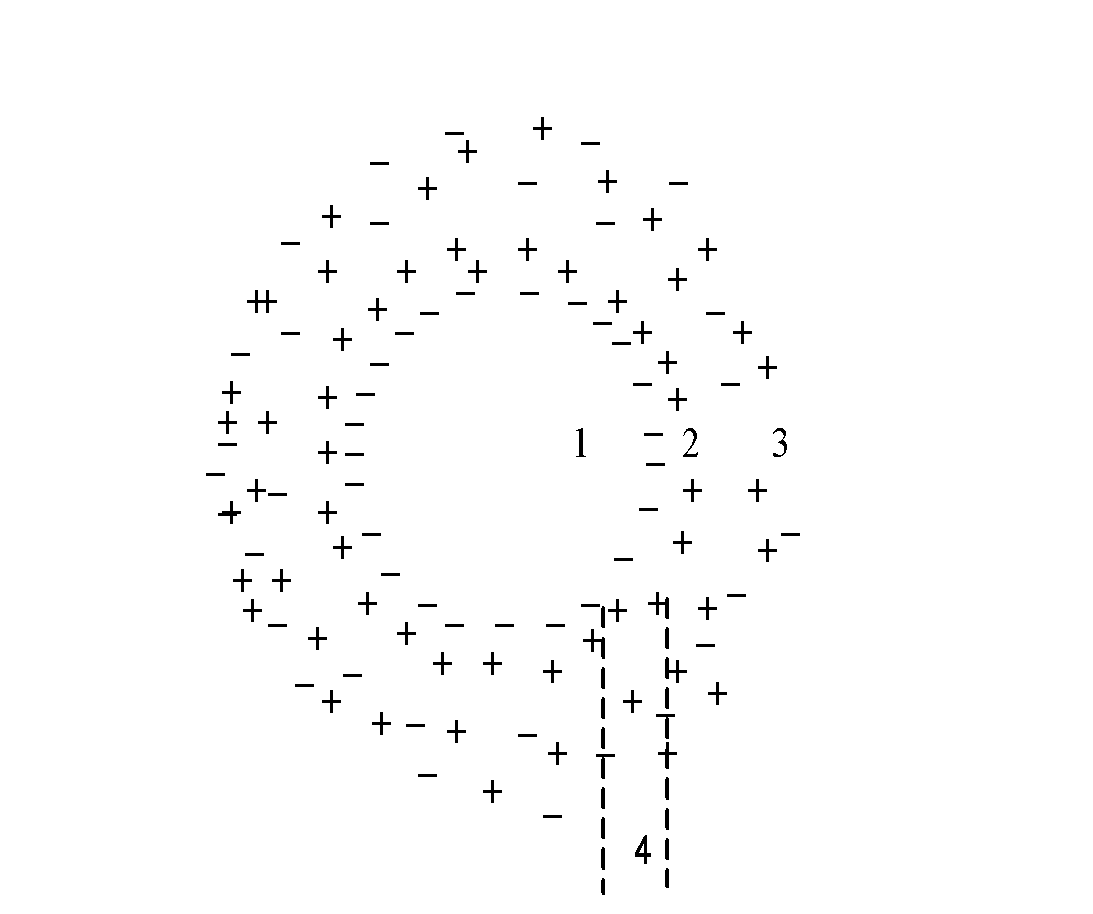
Hình 1.2. Cấu tạo hạt keo [3,4]
Trong đó:
- Là nhân keo 2. Lớp hấp phụ
- Là lớp khuyếch tán 4. Lớp điện tích kép
Quá trình keo tụ xảy ra theo các cơ chế:
– Hấp phụ và trung hoà điện tích: khi môi trường pH phù hợp cho quá trình hấp phụ của các cấu tử nhôm trên bề mặt các chất gây đục, hiện tượng keo tụ xảy ra. Quá trình hấp phụ xảy ra trong một hệ có độ phân tán cao nên tốc độ hấp phụ rất lớn. Nếu hệ được khuấy trộn tốt, thời gian đạt tới cân bằng chỉ tính bằng phút.
– Cơ chế lôi cuốn, quét: bản thân chất keo tụ phèn nhôm tự nó đã có thể kết tủa và lắng. Khi nồng độ huyền phù thấp các chất gây đục khó tạo thành tập hợp lớn để lắng. Nên để kết tủa hết hệ đó cần thêm một lượng chất keo tụ.
Nồng độ chất keo tụ cao, đạt mức siêu bão hoà sẽ tự nó kết tủa và lắng, trong quá trình đó nó sẽ cuốn theo các hạt đục cùng lắng.
– Cơ chế hấp phụ và tạo cầu nối giữa các hạt: sau khi hạt huyền phù được khử điện tích bề mặt, chúng có thể co cụm lại thành các tập hợp lớn, quá trình này diễn ra chậm. Để thúc đẩy người ta bổ sung thêm polyme trợ keo tụ vào hệ, các polyme này sẽ bị hấp phụ trên bề mặt chất gây đục theo kiểu mỏ neo, tức là một phân tử polyme có thể bị hấp phụ trên nhiều hạt gây đục. Chúng đóng vai trò chiếc cầu nối của các chất gây đục, kéo chúng lại với nhau tạo thành cụm lớn. Tốc độ này xảy ra rất nhanh chỉ chừng vài phút.
– Cơ chế keo tụ hấp phụ cùng lắng: các ion kim loại hóa trị cao sử dụng trong quá trình keo tụ như Al3+ tạo ra trong nước các sản phẩm thủy phân khác nhau như Al(OH)4-, Al(OH)2+…Ở các giá trị cao và thấp của pH, các liên kết này tồn tại và tích điện, nhưng ở một giá trị pH trung bình nào đó thì chỉ có mặt các hydroxyt nhôm tạo ra lập tức chúng lắng xuống. Trong quá trình lắng chúng kéo theo cả các bông keo và tạp chất có trong hệ huyền phù như các hạt keo khác, các cặn bẩn, các chất hữu cơ, chất mang mùi tồn tại ở trạng thái hòa tan hay lơ lửng.
Động học của quá trình keo tụ
– Khi hệ keo trong nước đã bị các chất keo tụ làm mất đi trạng thái ổn định của nó tốc độ tạo bông keo quyết định bởi sự chuyển động tạo ra sự tiếp xúc giữa các hạt keo với nhau nhờ sự khuếch tán và chuyển động có hướng. Khuếch tán chỉ có tác dụng hình thành bông keo nhỏ, để hình thành bông keo có kích thước lớn phải có chuyển động định hướng của các hạt keo để chúng tiếp xúc với nhau.
– Dưới tác động của chuyển động nhiệt, ban đầu các hạt cặn có kích thước nhỏ va chạm và kết dính tạo thành hạt có kích thước lớn cho đến khi chúng không không còn khả năng tham gia vào chuyển động nhiệt nữa. Lúc này tác động khuấy trộn tham gia vào quá trình tạo bông cặn lớn hơn.
1.4.1.1. Phương pháp keo tụ dùng chất điện ly đơn giản
Bản chất của phương pháp là cho vào nước các chất điện ly ở dạng ion đơn giản ngược dấu. Khi nồng độ các ion ngược dấu tăng lên thì càng có nhiều ion được chuyển từ lớp khuếch tán vào lớp điện tích kép, dẫn tới việc giảm độ lớn của thế điện động zeta, đồng thời lực đẩy tĩnh điện cũng giảm đi. Nhờ chuyển động Brown các hạt keo với điện tích bé khi va chạm dễ kết dính bằng lực hút Vander Walls tạo nên các bông cặn ngày càng lớn và dễ dàng lắng xuống.
Quá trình keo tụ bằng các chất điện ly đơn giản được xem như một cơ chế keo tụ tối ưu vì nó giải thích qua sự nén điện trong lớp khuếch tán vào lớp điện tích kép để phá vỡ trạng thái ổn định của hệ keo trong nước.
Trong thực tế, quá trình keo tụ dùng chất điện ly đơn giản ít có ý nghĩa do nồng độ chất điện ly để đạt tới việc phá vỡ trạng thái ổn định của hệ keo đồi hỏi rất cao. Kết quả thực nghiệm cho thấy rằng, khi sử dụng chất điện ly với các ion có hóa trị cao, hiệu quả keo tụ càng lớn và nồng độ chất điện ly đòi hỏi sẽ giảm đi. Cũng như các phương pháp keo tụ khác, keo tụ dùng các chất điện ly đơn giản đòi hỏi liều lượng chất điện ly cho vào nước phải thật chính xác. Nếu nồng độ chất điện ly trong nước vượt quá mức cần thiết sẽ dẫn đến quá trình tích điện trở lại với các hạt keo, làm điện thế điện động zeta tăng lên, hiệu quả keo tụ giảm đi và hệ keo trong nước sẽ trở về trạng thái bền vững.
Do các nhược điểm nói trên, trong thực tế xử lý nước phương pháp keo tụ dùng chất điện ly đơn giản rất ít khi và hầu như không được sử dụng.
1.4.1.2. Phương pháp keo tụ bằng hệ keo ngược dấu
Quá trình keo tụ được thực hiện bằng cách tạo ra trong nước một hệ keo mới tích điện ngược dấu với hệ keo cặn bẩn trong nước và các hạt keo tích điện trái dấu sẽ trung hòa lẫn nhau.
Trong quá trình này người ta sử dụng muối nhôm hay còn gọi là phèn nhôm làm chất keo tụ, là loại hóa chất rất thông dụng trong xử lý nước cấp, nước thải nhất là xử lý nước sinh hoạt. Muối này được đưa vào nước dưới dạng dung dịch hòa tan, trong dung dịch chúng phân ly thành các cation và anion theo phản ứng sau :
![]()
Nhờ hóa trị cao của các ion nhôm kim loại, chúng có khả năng ngậm nước tạo thành phức chất hexa [Al(H2O)6]+3. Tùy vào giá trị pH của môi trường mà chúng có khả năng tồn tại ở các đều kiện khác nhau, các phức chất này tồn tại ở pH từ 3 đến 4
Khi tăng pH các phản ứng xảy ra như sau:
![]()
Tăng acid
![]()
Tăng kiềm
![]()
![]()
Với nhôm khi pH bắt đầu từ 6 trở lên, các phản ứng dừng lại ở trạng thái hydroxit Al(OH)3 kết tủa lắng xuống. Độ hòa tan của các hydroxit Al(OH)3 quá nhỏ nên ở pH tối ưu các ion kim loại này được tách hết ra khỏi nước. Quá trình tạo thành Al(OH)4- chỉ xảy ra khi pH ≥ 7,5.
Các sản phẩm hydroxit tan tạo thành trong phạm vi pH từ 3 đến 6, đó là các sản phẩm mang nhiều nguyên tử kim loại. Các hợp chất này mang điện tích dương mạnh và có khả năng kết hợp với các hạt keo tự nhiên mang điện tích âm tạo thành bông cặn. Các hydroxit nhôm tạo thành khác nhau tùy thuộc vào pH và các điều kiện của quá trình, song chúng đều là những hợp chất mang điện dương và có hoạt tính tạo bông keo tụ cao nhờ hoạt tính bề mặt lớn. Các bông keo này khi lắng xuống sẽ hấp phụ, cuốn theo các hạt keo, cặn bẩn chất hữu cơ, chất mang màu…tồn tại ở trạng thái hòa tan hoặc lơ lửng trong nước. Mặt khác, ion kim loại tự do còn kết hợp với nước qua phản ứng thủy phân cũng tạo thành các hydroxit như sau:
![]()
Các loại phèn nhôm thường được sử dụng trong quá trình keo tụ như nhôm sunfat Al2(SO4)3.14H2O, Al2(SO4)3.18H2O, nhôm clorua AlCl3.6H2O, aluminat natri NaAlO2…
1.4.1.3. Phương pháp keo tụ hoặc tăng cường quá trình keo tụ bằng các hợp chất cao phân tử
Quá trình này sử dụng các chất cao phân tử tan trong nước, chúng có cấu tạo mạch dài, với phân tử lượng từ 103-107g/mol và đường kính phân tử trong dung dịch vào khoảng 0,1m đến 1m. Chúng cũng còn được sử dụng làm chất trợ keo tụ, tức là sử dụng cùng phèn nhôm là chất keo tụ chính. Chúng giúp cho quá trình keo tụ xảy ra nhanh hơn và tạo ra các bông keo có kích thước lớn hơn để có thể tách ra khỏi nước một cách dễ dàng.
Dựa vào hóa trị người ta phân chia các loại cao phân tử dùng trong keo tụ ra thành ba loại: loại anion, cation và loại không ion. Ngoài ra cũng có thể phân chia chúng theo cấu tạo hóa học, theo độ lớn phân tử lượng cũng như độ tích điện của chúng. Ngoài các chất cao phân tử tự nhiên người ta sử dụng cả các chất cao phân tử tổng hợp làm chất keo tụ.
Các chất cao phân tử không ion mạch thẳng, phân tử lượng rất cao và là một trong những chất keo tụ tốt như polynatriacrylat (là sản phẩm trùng hợp của natriacrylat), N-dimetylamino propylmethacrylat (được trùng hợp từ acrylamit), polyacrylamit (là sản phẩm trùng hợp của acrylamit). Các polyme cấu tạo mạch dài, phân tử lượng cao. Trong nước, chúng keo tụ các hạt cặn bẩn dưới dạng liên kết chuỗi. Các liên kết này tạo điều kiện thuận lợi cho việc hình thành và lắng tủa bông cặn.
Trong xử lý nước hiện nay thường dùng nhiều các chất polymer tự nhiên, các polyacrylamit anion và không ion. Lượng polymer dùng tối đa đến 0,5 mg/l. Tuy nhiên các loại polyme này có nhược điểm là không bảo quản được lâu, đặc biệt khi hòa tan trong nước, công nghệ sản xuất tốn kém, giá thành cao. Vì vậy việc sử dụng polyme làm chất keo tụ ở nước ta còn bị hạn chế.
1.4.1.4. Các yếu tố ảnh hưởng đến quá trình keo tụ [9]
Phương pháp keo tụ bằng các chất điện ly hay các hợp chất cao phân tử đều ít được sử dụng rộng rãi mà chủ yếu là phương pháp keo tụ bằng hệ keo ngược dấu hay gọi đơn giản là keo tụ bằng phèn nhôm.
Trị số pH của nước
Nước thiên nhiên sau khi đã cho Al2(SO4)3 vào, trị số pH của nó bị giảm thấp, vì Al2(SO4)3 là một loại muối tạo thành từ acid mạnh và bazo yếu. Sự thủy phân có thể làm tăng tính acid của nước. Hiệu quả keo tụ ảnh hưởng chủ yếu là trị số pH của nước sau khi cho phèn vào.
Trị số pH của nước có ảnh hưởng rất lớn và nhiều mặt đến quá trình keo tụ
– Ảnh hưởng của pH đối với độ hòa tan của nhôm hydroxit. Là một hydroxit lưỡng tính điển hình, trị số pH của nước quá cao hoặc quá thấp đều ảnh hưởng đến quá trình hòa tan.
Trong môi trường acid:
Môi trường acid yếu:
![]()
Al(OH)2+ là ion tạo thế, OH- là ion đối hạt keo (+)
Môi trường acid mạnh (pH thấp):
![]()
Kết quả dung dịch keo chuyển thành dung dịch thật.
Trong môi trường kiềm:
Môi trường bazo yếu:
![]()
Al(OH)2O- là ion taọ thế, H+là ion đối hạt keo (-)
Môi trường bazo mạnh:
![]()
Khi OH- cao hơn nữa, Al(OH)3 tan trong dung dịch bazo tạo nên aluminat và dung dịch keo trở thành dung dịch thật. Trong nước có ion SO42-, ở phạm vi pH 5,5 – 7 trong vật kết tủa có muối sunfat kiềm rất ít hòa tan. Khi giá trị pH biến đổi cao muối sunfat kiềm ở hình thái Al2(OH)4SO4, khi giá trị pH biến đổi thấp thì ở hình thái Al(OH)SO4. Tóm lại trong phạm vi pH 5,5 – 7, lượng nhôm dư trong nước đều rất nhỏ.
– Ảnh hưởng của pH đối với điện tích hạt keo nhôm hydroxit
Điện tích của hạt keo trong dung dịch nước có quan hệ thành phần với ion của nước, đặc biệt là với nồng độ ion H+. Cho nên trị số pH đối với tính năng mang điện của hạt keo có ảnh hưởng rất lớn. Khi 5<pH<8, hạt keo mang điện dương. Cấu tạo của đám keo này do sự phân hủy của nhôm sunfat mà hình thành. Khi pH<5 do hấp phụ ion SO42- mà hạt keo mang điện tích âm. Khi pH= 8, hạt keo tồn tại ở trạng thái hydroxit trung tính nên dễ dàng kết tủa nhất.
-Ảnh hưởng của pH đối với các chất hữu cơ trong nước
Chất hữu cơ trong nước như các thực vật bị thối rửa, khi pH thấp dung dịch keo của acid humic mang điện âm. Lúc này, dễ dàng dùng chất keo tụ khử đi. Khi pH cao, nó trở thành muối axit humic dễ tan. Vì thế mà hiệu quả khử tương đối kém. Dùng muối nhôm khử loại này thích hợp nhất ở pH= 6-6,5.
– Ảnh hưởng của pH đối với tốc độ keo tụ dung dịch keo
Tốc độ keo tụ dung dịch keo và điện thế điện động của nó có quan hệ. Trị số điện thế điện động càng nhỏ, lực đẩy giữa các hạt càng yếu thì tốc độ keo tụ của nó càng nhanh. Khi điện thế điện động bằng 0, nghĩa là đạt đến điểm đẳng nhiệt, tốc độ keo tụ của nó lớn nhất. Dung dịch keo hình thành từ hợp chất lưỡng tính, điện thế điện động của nó và điểm đẳng điện chủ yếu quyết định bởi trị số pH của nước. Nhôm hydroxit và các chất humic, đất sét hợp thành dung dịch keo trong nước thiên nhiên đều là lưỡng tính, cho nên pH là nhân tố chủ yếu ảnh hưởng đến tốc độ keo tụ.
Từ một số nguyên nhân trên, đối với một loại nước cụ thể thì không có phương pháp tính toán trị số pH tối ưu mà chỉ xác định bằng thực nghiệm. Chất lượng nước khác nhau, trị số pH tối ưu khác nhau. Nghĩa là cũng cùng một nguồn nước, các mùa khác nhau trị số pH tối ưu cũng có thể thay đổi.
Khi dùng muối nhôm làm chất keo tụ, trị số pH tối ưu nói chung nằm trong giới hạn 6,5-7,5. Nói chung, khi lượng chất keo tụ cho vào tương đối ít, dung dịch keo tụ tự nhiên trong nước chủ yếu là dựa vào quá trình keo tụ bản thân nó mà tách ra. Nên dùng pH tương đối thấp là thích hợp vì khi này lượng điện tích dương của dung dịch keo nhôm hydroxit tương đối lớn, rất có lợi để trung hòa điện tích âm của dung dịch keo tự nhiên, giảm thấp điện thế điện động của nó. Khi lượng phèn cho vào tương đối nhiều, chủ yếu là làm cho dung dịch keo nhôm hydroxit hình thành chất keo tụ càng tốt. Để khử đi vật huyền phù và dung dịch keo tự nhiên trong nước, là dựa vào tác dụng hấp phụ của dung dịch keo nhôm hydroxit, cho nên khi pH gần bằng 8 là thích hợp nhất, vì nhôm hydroxit dễ kết tủa xuống.
Nếu độ kiềm của nước nguồn quá thấp sẽ không đủ để khử tính acid do chất keo tụ thủy phân sinh ra. Làm cho trị số pH của nước sau khi cho phèn vào quá thấp. Ta có thể dùng biện pháp cho kiềm vào để điều chỉnh trị số pH của nước. Kiềm cho vào có thể dung xút (NaOH), natricacbonat (Na2CO3) hay canxi hydroxit.
Nồng độ (lượng ) chất keo tụ
Quá trình keo tụ không phải là một loại phản ứng hóa học đơn thuần, nên lượng phèn cho vào không thể căn cứ vào tính toán để xác định. Tùy điều kiện cụ thể khác nhau, phải làm thực nghiệm chuyên môn để tìm ra lượng phèn tối ưu cho vào. Lượng phèn tối ưu cho vào trong nước thường trong khoảng 0,1-0,5mgđl/l, nếu dùng Al2(SO4)3.18H2O thì tương đương 10-50 mg/l. Huyền phù trong nước càng nhiều, lượng chất keo tụ cần thiết càng lớn. Cũng có thể chất hữu cơ trong nước tương đối ít mà lượng chất keo tụ vẫn cần tương đối nhiều.
Nhiệt độ nước
Khi dùng muối nhôm làm chất keo tụ, nhiệt độ ảnh hưởng lớn đến hiệu quả keo tụ. Nếu nhiệt độ nước rất thấp (thấp hơn 50C), bông phèn sinh ra to mà xốp, chứa phần nước nhiều, lắng xuống rất chậm nên hiệu quả kém.
Khi dùng nhôm sunfat tiến hành keo tụ nước thiên nhiên, nhiệt độ nước tốt nhất là 25-300C. Quan hệ tốc độ hỗn hợp của nước và chất keo tụ dẫn đến tính phân bổ đồng đều của chất keo tụ. Cơ hội va chạm giữa các hạt keo cũng là một nhân tố quan trọng ảnh hưởng đến quá trình keo tụ. Tốc độ khuấy tốt nhất là từ nhanh chuyển sang chậm. Khi mới cho chất keo tụ vào nước phải khuấy nhanh vì sự thủy phân của chất keo tụ trong nước và tốc độ hình thành keo. Do đó mới có khả năng sinh thành lượng lớn keo hydroxit hạt nhỏ và làm cho nó nhanh chóng khuếch tán đến các nơi trong dung dịch kịp thời cùng với các tạp chất có trong hệ keo tụ. Khi hỗn hợp hình thành, bông phèn lớn lên không nên khuấy quá nhanh vì không những bông phèn khó lớn lên mà còn có thể đánh vỡ những bông phèn đã hình thành.
Chất điện ly
Nếu cho các ion ngược dấu vào dung dịch có thể làm cho dung dịch có khả năng keo tụ. Vì vậy ion ngược dấu cũng là một yếu tố ảnh hưởng đến quá trình keo tụ. Khi dùng Al2(SO4)3 làm chất keo tụ, dung dịch Al(OH)3 sinh thành thường mang điện tích dương nên ảnh hưởng của tạp chất trong nước đến quá trình keo tụ dung dịch keo chủ yếu là anion. Người ta đã tiến hành thí nghiệm các loại dung dịch có chứa tổng nồng độ 10mgđl/l của ba loại anion là HCO3-, SO42-, Cl- và cho thấy ion HCO3- hay SO42- + Cl- với lượng quá nhiều đều làm cho hiệu quả keo tụ xấu đi. Nhưng vì ảnh hưởng đó rất phức tạp, hiện nay người ta chưa nắm chắc được quy luật của nó.
Tạp chất trong nước
Khi trong nước có chứa một lượng lớn chất hữu cơ cao phân tử (như acid humic) nó có thể hấp phụ trên bề mặt dung dịch keo bảo vệ dung dịch keo làm cho hạt keo thu được khó keo tụ nên hiệu quả keo tụ trở nên xấu đi. Trường hợp này có thể dùng biện pháp cho Clo hay khí ozon vào để phá hủy các chất hữu cơ đó.
Môi chất tiếp xúc
Khi tiến hành keo tụ hay xử lý bằng phương pháp kết tủa khác, nếu trong nước duy trì một lớp cặn bùn nhất định thì sẽ cho quá trình kết tủa càng hoàn toàn và nhanh thêm. Lớp cặn bùn đó có tác dụng làm môi chất tiếp xúc trên bề mặt, nó có tác dụng thúc đẩy hấp phụ. Tác dụng của các hạt cặn bùn đó như những hạt nhân kết tinh, cho nên thiết bị dùng để keo tụ hoặc xử lý bằng kết tủa khác phần lớn được thiết kế có lớp cặn bùn.
CHƯƠNG 2: THỰC NGHIỆM
2.1. Các phương pháp kiểm tra chất lượng nước
2.1.2. Phương pháp đo độ màu của nước theo thang Coban
2.1.2.1. Cơ sở phương pháp
Màu của nước được biểu thị bằng độ Coban, và được xác định bằng phương pháp so màu. Màu của nước tỷ lệ với nồng độ chất tạo ra màu trong nước theo định luật Lamber-Beer: khi chiếu chùm ánh sáng đơn sắc qua dung dịch chất mầu có bề dày 1(cm), nồng độ C(mol/l) thì giá trị của mật độ quang A được xác định bởi công thức:
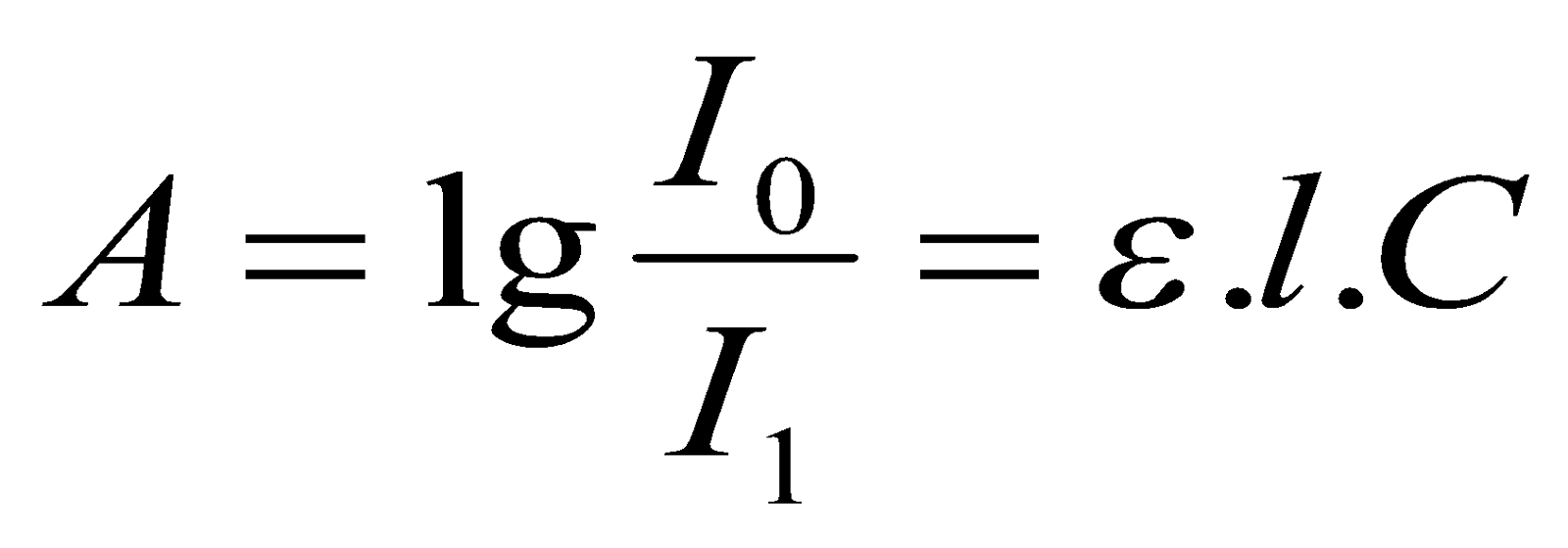
Trong đó:
ε: là hệ số hấp thụ phân tử (hệ số tắt phân tử).
I0, I1: là cường độ ánh sáng tới và ánh sáng ló ra khỏi cuvet.
l: là bề dày của cuvet.
C: là nồng độ chất màu.
Như vậy, mật độ quang tỷ lệ với nồng độ các chất màu trong nước, tức là tỷ lệ với độ màu của nước.
2.1.2.2. Dụng cụ hóa chất
Dụng cụ
– Pipet 2, 5,10ml
– Buret 250ml
– Bình định mức loại: 1000ml, 100ml
– Cân phân tích, máy đo quang, cuvet 1cm
Hóa chất
-KaliBicromat (K2Cr2O7)
-Axit sunfuric đặc H2SO4 (d = 1.84)
– Coban Sunfat (CoSO4)
2.1.2.3. Cách tiến hành
Dung dịch bicromat Coban CoCr2O7 được pha như sau: dung dịch 1 (D1), cân chính xác 0,0875g K2Cr2O7, 2g CoSO4.7H2O và dùng pipet lấy 1ml H2SO4 (d = 1,84) vào bình định mức 1000 ml rồi thêm nước cất đến vạch.
Dung dịch 2 (D2): làm tương tự như pha dung dịch 1(D1) nhưng với khối lượng của K2Cr2O7 là 0,175g và của CoSO4.7H2O là 4g
Dung dịch trống (T): lấy 1 ml H2SO4 (d = 1,84) cho vào bình định mức 1000 ml rồi thêm nước cất đến vạch.
Pha dung dịch chuẩn độ Coban theo bảng sau, tương ứng với mỗi mẫu sẽ là một số chỉ độ Coban
Bảng 2.1. Tỷ lệ pha dung dịch mẫu và độ màu
| Mẫu | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| D1 | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| T | 100 | 95 | 90 | 85 | 80 | 75 | 70 | 65 | 60 | 55 |
| Độ màu | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 | 225 |
| Mẫu | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| D1 | 50 | 55 | 60 | 65 | 70 | 75 | 80 | 85 | D2 | 50 |
| T | 50 | 45 | 40 | 35 | 30 | 25 | 20 | 15 | 50 | |
| Độ màu | 250 | 275 | 300 | 325 | 350 | 375 | 400 | 425 | 500 | |
| Mẫu | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| D2 | 55 | 60 | 65 | 70 | 75 | 80 | 85 | 90 | 95 | 100 |
| T | 45 | 40 | 35 | 30 | 25 | 20 | 15 | 10 | 5 | 0 |
| Độ màu | 550 | 600 | 650 | 700 | 750 | 800 | 850 | 900 | 950 | 1000 |
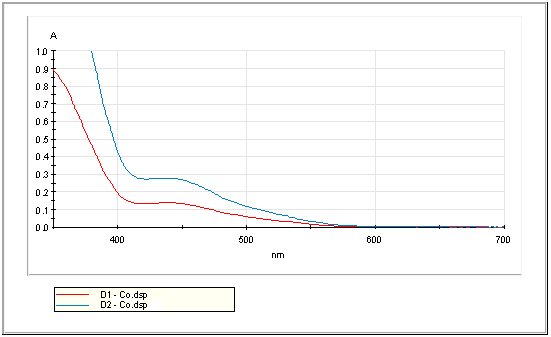
Hình 2.1. Phổ UV-VIS của dung dịch D1 và D2
Vậy ta chọn bước sóng = 440
Bảng 2.2. Bảng giá trị mật độ quang theo độ màu của dung dịch chuẩn CoCr2O7
| Độ màu | 0 | 50 | 100 | 150 | 200 | 250 | 300 | 400 | 500 |
| A | 0 | 0.019 | 0.050 | 0.068 | 0.095 | 0.126 | 0.154 | 0.202 | 0.254 |
| Độ màu | 600 | 650 | 700 | 750 | 800 | 850 | 900 | 950 | 1000 |
| A | 0.306 | 0.348 | 0.368 | 0.390 | 0.424 | 0.447 | 0.479 | 0.500 | 0.523 |
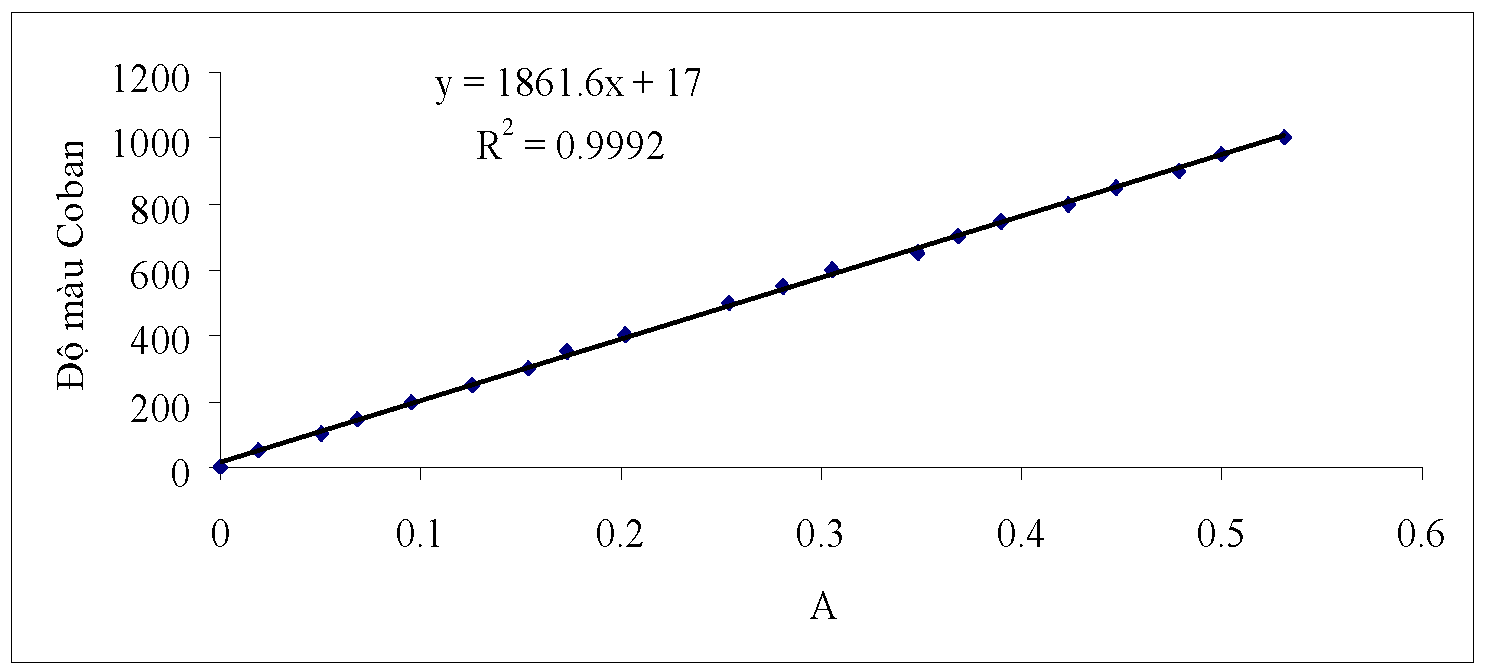
Hình 2.2. Đồ thị đường chuẩn quan hệ giữa độ màu Coban và độ hấp thu A
Từ bảng số liệu thu được ta dựng được đồ thị như hình 2.2 đồng thời cũng có thể tìm được phương trình đường chuẩn như sau:
y=1861.6x + 17
R2= 0.9992
Trong đó :
x: là giá trị mật độ quang đo được
y: là độ Coban
R2: là hệ số hồi quy
Như vậy thông qua việc đo mật độ quang của mẫu nước thải và dung dịch trống trong xây dựng đường chuẩn. Với các giá trị mật độ quang A đo được ta có thể dùng đồ thị hoặc phương trình hồi quy suy ra được độ màu coban của mẫu cần xác định.
2.1.2.4. Công thức tính hiệu suất
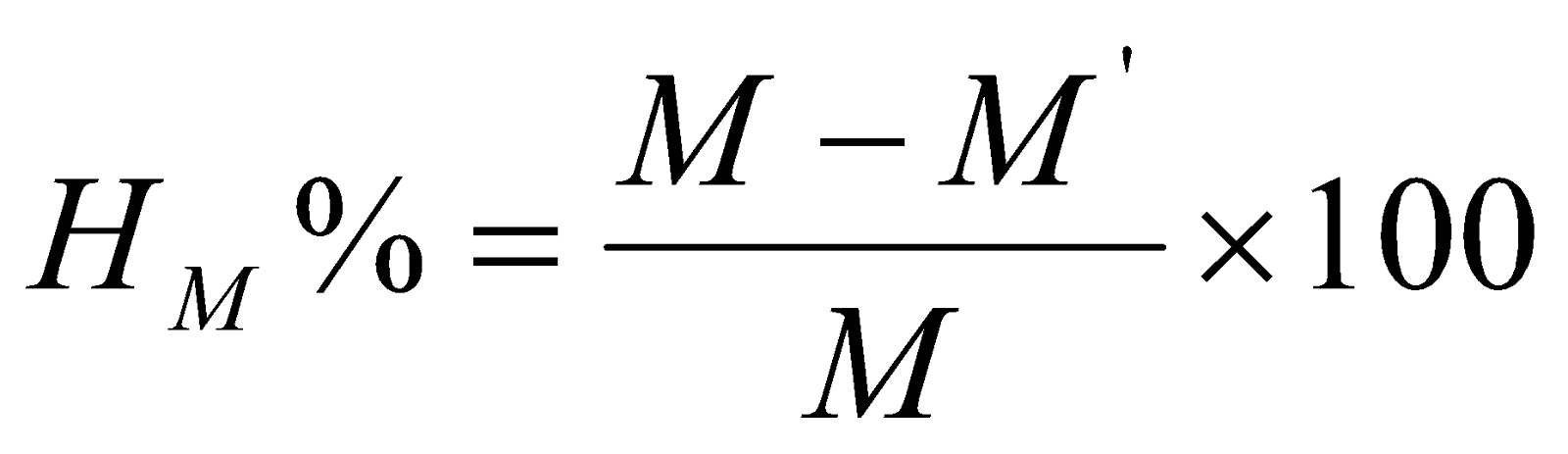
Trong đó:
HM% : là hiệu suất của độ màu coban
M: là độ màu coban ban đầu của nước
M’: là độ màu coban sau khi xử lý
2.2. Các phương pháp xử lý nước thải
2.2.1. Phương pháp keo tụ bằng phèn kali nhôm sunfat
2.2.1.1. Cơ sở của phương pháp
Khi cho phèn kali nhôm sunfat vào dung dịch chúng sẽ bị thủy phân thành nhôm hydroxyt Al(OH)3 kết tủa có vai trò là tác nhân keo, hấp phụ lên bề mặt của nó những các ion và các tạp chất có trong dung dịch để tạo thành hạt keo mà cấu tạo có thể viết như sau:
{m[Al(OH)3].2nAl3+.3(n-x)SO42-}+ 3x SO42-
Các hạt keo được hình thành với nồng độ đủ lớn này trong đều kiện khuấy trộn thích hợp sẽ kết tụ lại với nhau để tạo thành hạt bông keo lớn lắng xuống và kéo theo các tạp chất khác lắng xuống đáy.
2.2.1.2. Dụng cụ, hóa chất và nước thải
Dụng cụ
– Becher dung tích 100ml, 250ml, 500ml, 1000ml
– Máy khuấy từ, phễu thủy tinh, giấy lọc
– Pipet 2ml, 5ml, 10ml
– Ống đong 100ml
– Máy đo pH ORion 420 A
– Máy đo quang Geacsys 20 Thermospectronic
– Bình định mức 50ml, 500ml, 1000ml
Hóa chất
– Chất keo tụ kali nhôm sufat dạng khan màu trắng, được pha thành dạng dung dịch
– Dung dịch H2SO4 1N, NaOH 2N dùng để điều chỉnh pH
– Chất trợ keo tụ polyacrylamit mạch thẳng
Nước thải:
– Nước thải dùng để nghiên cứu là nước thải giả định chứa thuốc nhuộm hoạt tính Sumifix Red-S2B
– Các thông số ban đầu của nước thải:
pH= 5.86
Độ màu coban là 607
Có màu đỏ
Nồng độ là 0,1N
2.2.1.3. Dựng đường chuẩn thuốc nhuộm Sumifix Red – S2B
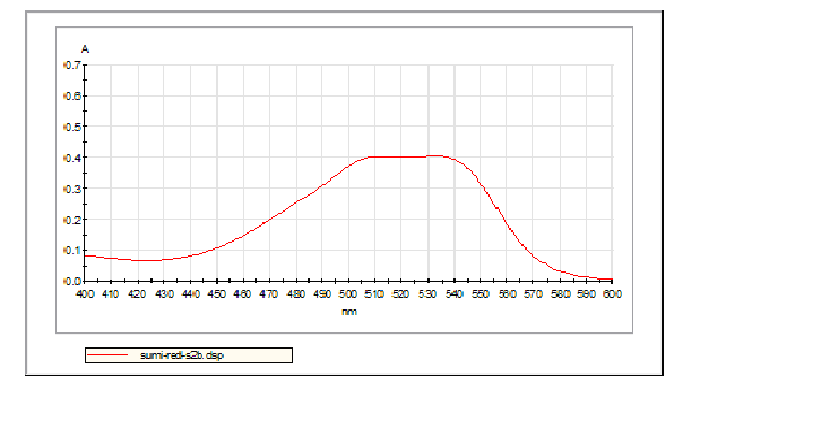 Hình 2.3. Phổ UV – VIS chuẩn thuốc nhuộm Sumifix Red-S2B
Hình 2.3. Phổ UV – VIS chuẩn thuốc nhuộm Sumifix Red-S2B
Vậy chọn bước sóng = 532 nm
Bảng 2.3. Kết quả số liệu đường chuẩn thuốc nhuộm sumific Red-S2B
| C(g/l) | 0 | 0.01 | 0.02 | 0.04 | 0.06 | 0.08 | 0.1 |
| A | 0 | 0.1786 | 0.3466 | 0.6893 | 1.0263 | 1.3603 | 1.6826 |
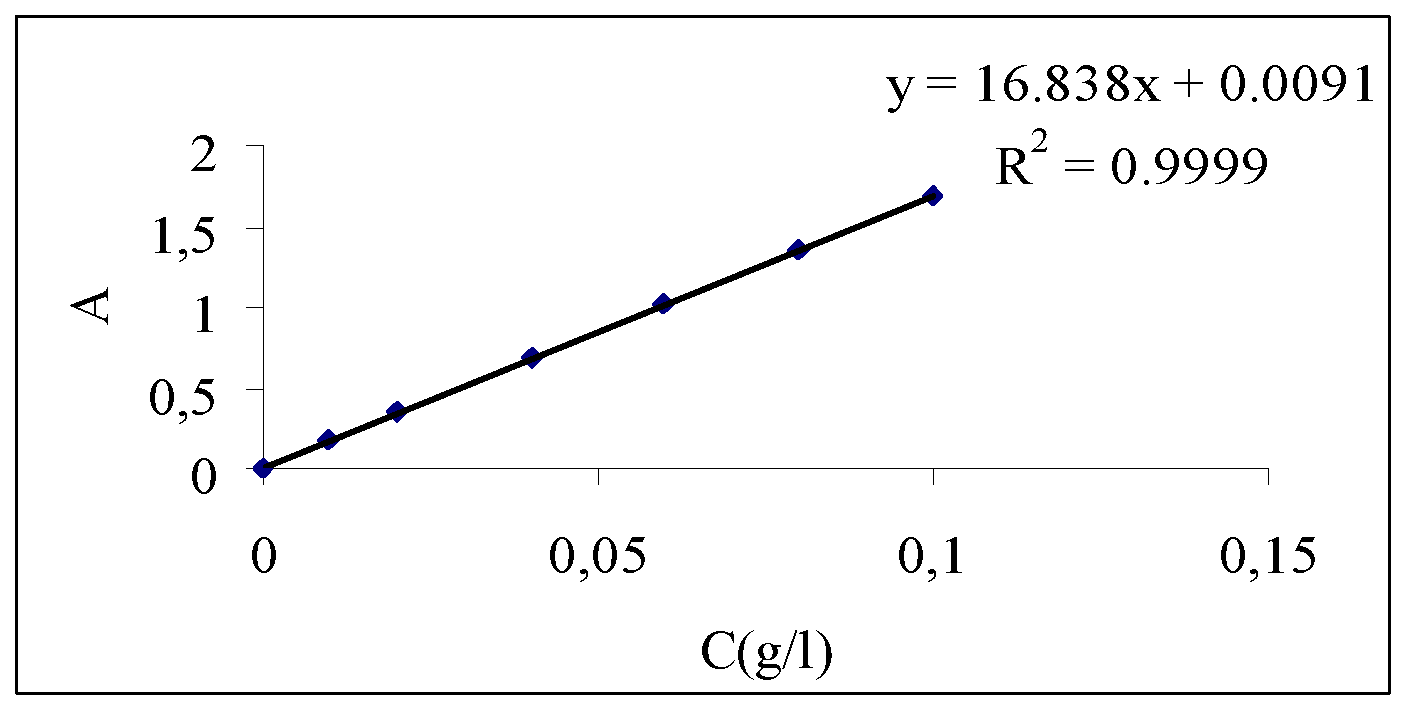
Hình 2.4. Đồ thị đường chuẩn mối quan hệ giữa nồng độ C(g/l) thuốc nhuộm Sumifix Red- S2B và độ hấp thu A
Từ bảng số liệu thu được ta dựng được đồ thị, đồng thời cũng có thể tìm được phương trình đường chuẩn như sau:
y =16.836x + 0.0091
R2= 0.9999
Trong đó:
y : là độ hấp thu A
x : là nồng độ C(g/l)
R2 : là chỉ số hồi lưu
Như vậy thông qua việc đo mật độ quang của mẫu nước thải trong xây dựng đường chuẩn. Với các giá trị mật độ quang A đo được ta có thể dùng đồ thị hoặc phương trình hồi quy suy ra được nồng độ của mẫu cần xác định.
2.2.1.4. Công thức tính hiệu suất
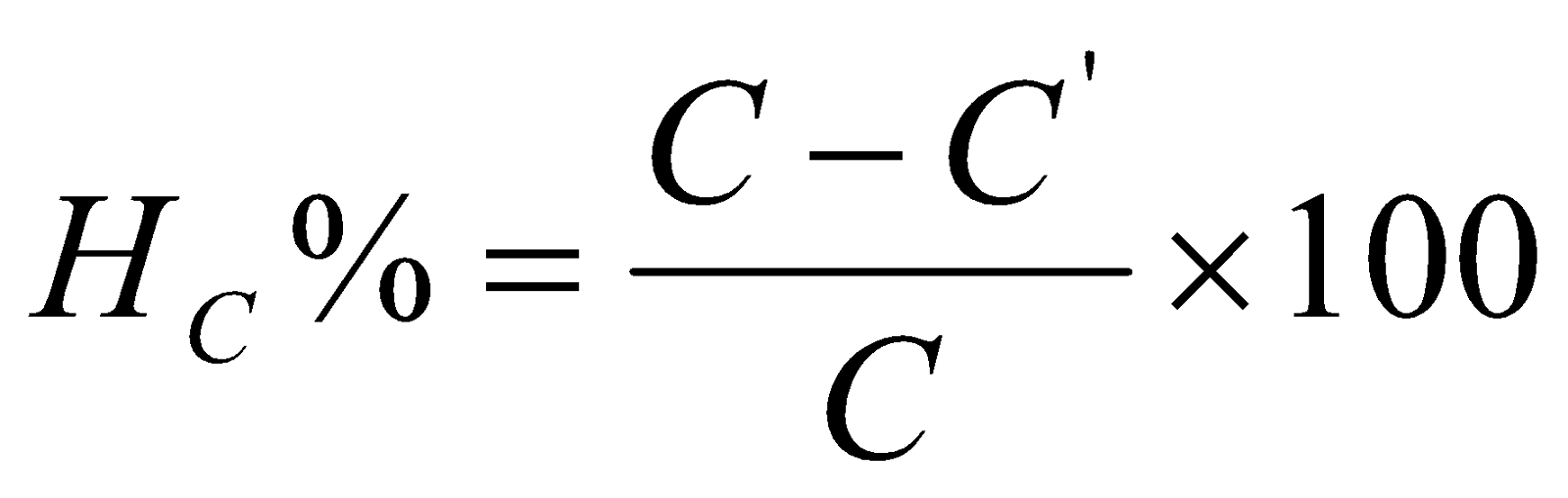
Trong đó:
HC% : là hiệu suất theo nồng độ thuốc nhuộm
C: là nồng độ ban đầu của mẫu thuốc nhuộm
C’: là nồng độ sau khi xử lý
2.2.1.5. Cách tiến hành
Quy trình keo tụ được thực hiện như sau:
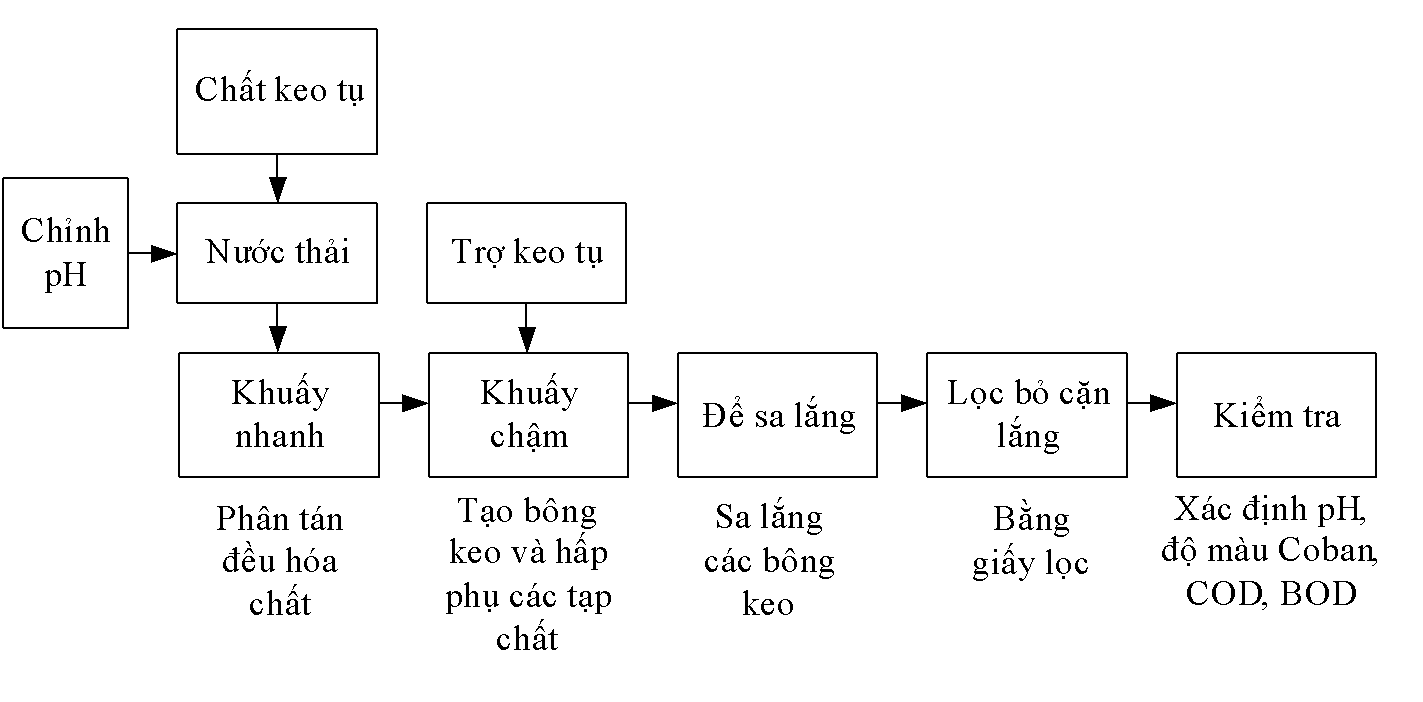
Hình 2.5. Sơ đồ tiến hành thí nghiệm
2.2.1.6. Khảo sát ảnh hưởng của nồng độ chất keo tụ
– Lấy 50ml nước thải vào mỗi becker 250ml với pH= 5.92
– Lấy 20ml phèn vào mỗi becher lần lượt thay đổi các nồng độ : 300, 350, 400, 450, 500, 550, 600, 650 mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Thời gian khuấy nhanh 1 phút, khuấy chậm 4 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng = 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.1.7. Khảo sát ảnh hưởng của liều lượng chất keo tụ
– Lấy 50ml nước thải thuốc nhuộm vào mỗi becker 250ml với pH= 5.92
– Lần lượt cho vào mỗi becher lượng phèn : 5, 10, 15, 20, 25, 30, 35, 40, 45 ml nồng độ 600mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Thời gian khuấy nhanh 1 phút, khuấy chậm 4 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng = 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.1.8. Khảo sát ảnh hưởng của pH
– Tiến hành thay đổi pH trong khoảng 2 -9
– Lấy 50ml nước thải đã thay đổi pH cho vào mỗi becker 250ml
– Lần lược cho vào mỗi becher 40ml chất keo tụ nồng độ 600mg/l
– Thêm 0,1 ml polyacrylamit với nồng độ 50mg/l
– Khuấy nhanh 1phút, khuấy chậm 4 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng = 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.1.9. Khảo sát ảnh hưởng của thời gian khuấy nhanh
– Lấy 50ml nước thải cho vào mỗi becker 250ml điều kiện pH =7
– Lần lược cho vào mỗi becher 40ml lượng chất keo tụ nồng độ 600mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Lần lượt tiến hành thay đổi thời gian khuấy nhanh từ 1 phút đến 7 phút, khuấy chậm 4 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng = 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.1.10. Khảo sát ảnh hưởng của thời gian khuấy chậm
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH = 7
– Lần lượt cho vào mỗi becher 40ml phèn với nồng độ phèn 600mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Thời gian khuấy nhanh: 2 phút, lần lượt tiến hành thay đổi thời gian khuấy chậm từ: 2, 4, 6, 8, 10, 12 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng = 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.1.11. Khảo sát ảnh hưởng của nồng độ chất trợ keo tụ
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher 40ml phèn với nồng độ phèn 600mg/l
– Tiến hành thay đổi nồng độ chất trợ keo tụ lần lượt: 10, 20, 30, 40, 50, 60, 70 mg/l
– Thời gian khuấy nhanh: 2 phút, khuấy chậm 8 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng = 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.1.12. Khảo sát ảnh hưởng của liều lượng chất trợ keo tụ
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher 40ml phèn với nồng độ phèn 600mg/l
– Thêm lượng trợ keo tụ lần lượt: 0,02, 0,04, 0,06, 0,08, 0,1, 0,12, 0,14 ml nồng độ 60mg/l
– Thời gian khuấy nhanh: 2 phút, khuấy chậm 8 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng = 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.2. Phương pháp keo tụ bằng phèn PAC
2.2.2.1. Khảo sát ảnh hưởng của nồng độ chất keo tụ
– Lấy 50ml nước thải vào mỗi becker 250ml có pH= 5.92
– Lấy 20ml phèn vào mỗi becher lần lượt các nồng độ : 300, 350, 400, 450, 500, 550, 600, 650 mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Khuấy nhanh 1 phút, khuấy chậm 4 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng = 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.2.2. Khảo sát ảnh hưởng của liều lượng chất keo tụ
– Lấy 50ml nước thải thuốc nhuộm vào mỗi becker 250ml có pH= 5.92
– Lần lược cho vào mỗi becher lượng phèn : 5, 10, 15, 20, 25, 30, 35, 40, 45 ml nồng độ 550mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Khuấy nhanh 1 phút, khuấy chậm 4 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.2.3. Khảo sát ảnh hưởng của pH
– Tiến hành thay đổi pH trong khoảng 2 -9
– Lấy 50ml nước thải đã thay đổi pH cho vào mỗi becker 250ml
– Lần lược cho vào mỗi becher 20ml phèn nồng độ 550mg/l
– Thời gian khuấy nhanh 1phút, khuấy chậm 4 phút
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.2.4. Khảo sát ảnh hưởng của thời gian khuấy nhanh
– Lấy 50ml nước thải cho vào mỗi becker 250ml điều kiện pH =7
– Lần lược cho vào mỗi cốc 20ml phèn nồng độ 550mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Lần lượt tiến hành thay đổi thời gian khuấy nhanh từ 1 phút đến 7 phút, khuấy chậm 4 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm vàđem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.2.5. Khảo sát ảnh hưởng của thời gian khuấy chậm
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH = 7
– Lần lượt cho vào mỗi becher 20ml phèn với nồng độ phèn 550mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Thời gian khuấy nhanh: 1 phút
– Lần lượt tiến hành thay đổi thời gian khuấy chậm từ : 2, 4, 6, 8, 10, 12 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.2.6. Khảo sát ảnh hưởng của nồng độ chất trợ keo tụ
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher 20ml phèn với nồng độ phèn 550mg/l
– Tiến hành thay đổi nồng độ chất trợ keo tụ lần lượt: 10, 20, 30, 40, 50, 60, 70 mg/l
– Thời gian khuấy nhanh: 1phút, khuấy chậm 6 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.2.2.7. Khảo sát ảnh hưởng của liều lượng chất trợ keo tụ
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher 40ml phèn với nồng độ phèn 550mg/l
– Thêm lượng trợ keo tụ lần lượt: 0,02, 0,04, 0,06, 0,08, 0,1, 0,12, 0,14 ml nồng độ 50mg/l
– Thời gian khuấy nhanh: 1 phút, khuấy chậm 6 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đo độ hấp thu ở bước sóng = 532nm và đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3. Áp dụng xử lý nước thải công ty TNHH Samil Vina Long Thành
2.3.1. Xử lý nước thải bằng phèn Kali Nhôm Sunfat
Các thông số ban đầu của nước thải công ty SamilVina:
pH= 8.20 BOD5= 120
COD= 475 Độ màu là 1113 có màu đen nhạt
2.3.1.1. Khảo sát ảnh hưởng của nồng độ chất keo tụ
– Lấy 50ml nước thải vào mỗi becker 250ml điều kiện pH= 7
– Lấy 40ml phèn vào mỗi becher lần lượt thay đổi các nồng độ : 600, 650, 700, 750, 800, 850, 900 mg/l
– Thêm 0,12ml polyacrylamit với nồng độ 60mg/l
– Thời gian khuấy nhanh 2 phút, khuấy chậm 8phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.1.2. Khảo sát ảnh hưởng của liều lượng chất keo tụ
– Lấy 50ml nước thải thuốc nhuộm vào mỗi becker 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher lượng phèn : 30, 35, 40, 45, 50, 55, 60ml nồng độ 850mg/l
– Thêm 0,12ml polyacrylamit với nồng độ 60mg/l
– Thời gian khuấy nhanh 2 phút, khuấy chậm 8 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.1.3. Khảo sát ảnh hưởng của pH
– Tiến hành thay đổi pH trong khoảng 5 -10
– Lấy 50ml nước thải đã thay đổi pH cho vào mỗi becker 250ml
– Lần lượt cho vào mỗi becher 40ml chất keo tụ nồng độ 850mg/l
– Thêm 0,12 ml polyacrylamit với nồng độ 60mg/l
– Khuấy nhanh 2 phút, khuấy chậm 8 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo quang với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.1.4. Khảo sát ảnh hưởng của thời gian khuấy nhanh
– Lấy 50ml nước thải cho vào mỗi becker 250ml điều kiện pH =7
– Lần lượt cho vào mỗi becher 40ml lượng chất keo tụ nồng độ 850mg/l
– Thêm 0,1ml polyacrylamit với nồng độ 50mg/l
– Lần lượt tiến hành thay đổi thời gian khuấy nhanh từ 2 phút đến 7 phút, khuấy chậm 8 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.1.5. Khảo sát ảnh hưởng của thời gian khuấy chậm
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH = 7
– Lần lượt cho vào mỗi becher 40ml phèn với nồng độ phèn 850mg/l
– Thêm 0,12ml polyacrylamit với nồng độ 60mg/l
– Thời gian khuấy nhanh: 6 phút, lần lượt tiến hành thay đổi thời gian khuấy chậm từ: 6, 8, 10, 12, 14, 16 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.1.6. Khảo sát ảnh hưởng của nồng độ chất trợ keo tụ
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher 40ml phèn với nồng độ phèn 850mg/l
– Tiến hành thay đổi nồng độ chất trợ keo tụ lần lượt: 60, 70, 80, 90, 100,111 mg/l
– Thời gian khuấy nhanh: 6 phút, khuấy chậm 12 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.1.7. Khảo sát ảnh hưởng của liều lượng chất trợ keo tụ
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher 40ml phèn với nồng độ phèn 850mg/l
– Thêm lượng trợ keo tụ lần lượt: 0,12, 0,14, 0,16, 0,18, 0,20, 0,22ml nồng độ 100mg/l
– Thời gian khuấy nhanh: 6 phút, khuấy chậm 12 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.2. Xử lý nước thải bằng phèn PAC
2.3.2.1. Khảo sát ảnh hưởng của nồng độ chất keo tụ
– Lấy 50ml nước thải vào mỗi becker 250ml điều kiện pH= 7
– Lấy 20ml phèn vào mỗi becher lần lượt thay đổi các nồng độ : 550, 600, 650, 700, 750, 800, 850, 900mg/l
– Thêm 0,06ml polyacrylamit với nồng độ 50mg/l
– Thời gian khuấy nhanh 1 phút, khuấy chậm 6 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.2.2. Khảo sát ảnh hưởng của liều lượng chất keo tụ
– Lấy 50ml nước thải thuốc nhuộm vào mỗi becker 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher lượng phèn : 20, 25, 30, 35, 40, 45, 50ml nồng độ 800mg/l
– Thêm 0,06ml polyacrylamit với nồng độ 50mg/l
– Thời gian khuấy nhanh 1 phút, khuấy chậm 6 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.2.3. Khảo sát ảnh hưởng của pH
– Tiến hành thay đổi pH trong khoảng 5 -10
– Lấy 50ml nước thải đã thay đổi pH cho vào mỗi becker 250ml
– Lần lượt cho vào mỗi becher 25ml chất keo tụ nồng độ 800mg/l
– Thêm 0,06ml polyacrylamit với nồng độ 50mg/l
– Khuấy nhanh 1 phút, khuấy chậm 6 phút
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo quang với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.2.4. Khảo sát ảnh hưởng của thời gian khuấy nhanh
– Lấy 50ml nước thải cho vào mỗi becker 250ml điều kiện pH =7
– Lần lượt cho vào mỗi becher 25ml lượng chất keo tụ nồng độ 800mg/l
– Thêm 0,06ml polyacrylamit với nồng độ 50mg/l
– Lần lượt tiến hành thay đổi thời gian khuấy nhanh từ 1 phút đến 7 phút, khuấy chậm 6 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.2.5. Khảo sát ảnh hưởng của thời gian khuấy chậm
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH = 7
– Lần lượt cho vào mỗi becher 25ml phèn với nồng độ phèn 800mg/l
– Thêm 0,06ml polyacrylamit với nồng độ 50mg/l
– Thời gian khuấy nhanh: 4 phút, lần lượt tiến hành thay đổi thời gian khuấy chậm từ: 4, 6, 8, 10, 12, 14 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.2.6. Khảo sát ảnh hưởng của nồng độ chất trợ keo tụ
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher 25ml phèn với nồng độ phèn 800mg/l
– Tiến hành thay đổi nồng độ chất trợ keo tụ lần lượt: 50, 60, 70, 80, 90, 100mg/l
– Thời gian khuấy nhanh: 4 phút, khuấy chậm 10 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
2.3.2.7. Khảo sát ảnh hưởng của liều lượng chất trợ keo tụ
– Lấy 50ml nước thải vào mỗi becher 250ml điều kiện pH= 7
– Lần lượt cho vào mỗi becher 20ml phèn với nồng độ phèn 800mg/l
– Thêm lượng trợ keo tụ lần lượt: 0.06, 0.08, 0.1, 0.12, 0.14ml nồng độ 100mg/l
– Thời gian khuấy nhanh: 4 phút, khuấy chậm 10 phút.
– Để lắng 15 phút rồi lọc đem phần nước đi xác định các chỉ số pH, đem đo với bước sóng= 440nm để xác định độ màu. Ghi lại và tính toán kết quả.
CHƯƠNG 3: KẾT QUẢ VÀ BÀN LUẬN
3.1. Kết quả xử lý nước thải giả định thuốc nhuộm Sumifix Red – S2B
3.1.1. Kết quả xử lý nước thải bằng phèn kali nhôm sunfat
3.1.1.1. Kết quả ảnh hưởng của nồng độ chất keo tụ
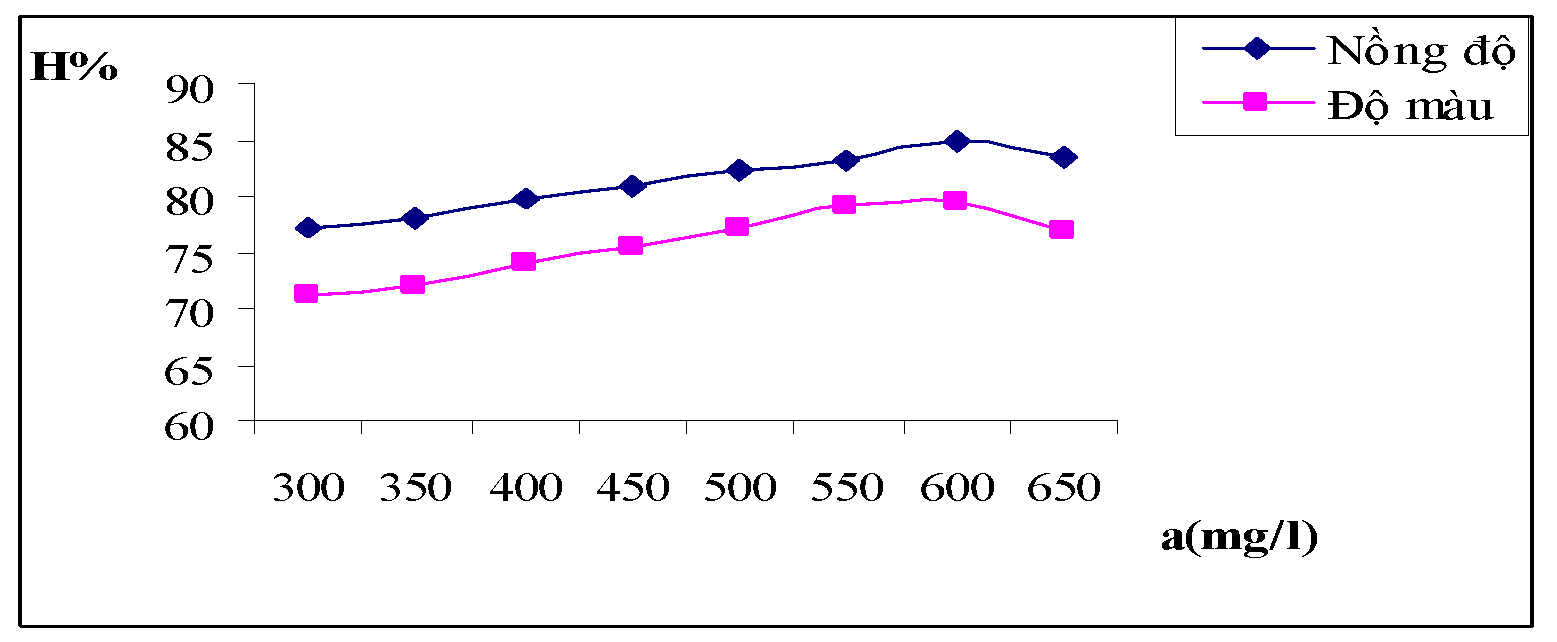
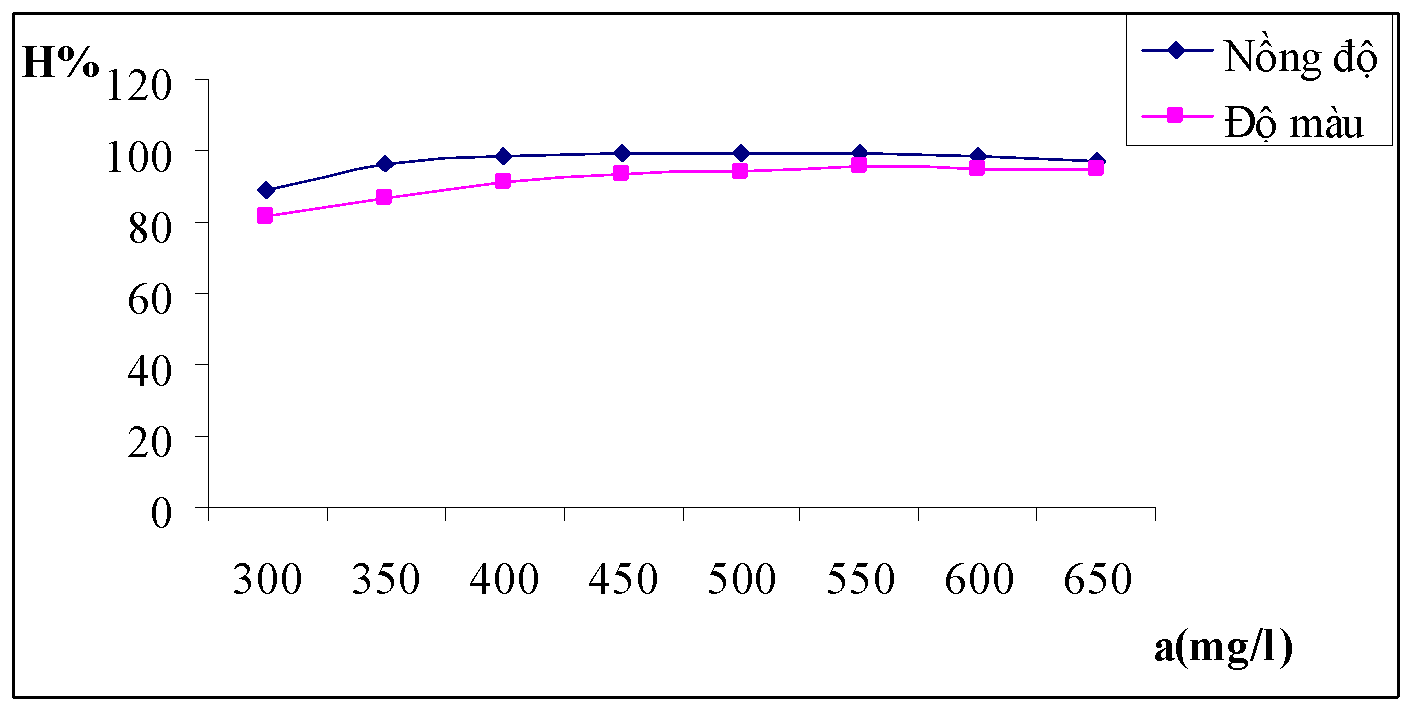
Bảng 3.1. Kết quả ảnh hưởng của nồng độ chất keo tụ
| a(mg/l) | 300 | 350 | 400 | 450 | 500 | 550 | 600 | 650 |
| A | 0.392 | 0.381 | 0.350 | 0.331 | 0.309 | 0.291 | 0.262 | 0.295 |
| HC% | 77.25 | 77.91 | 79.75 | 80.88 | 82.16 | 83.25 | 84.97 | 83.31 |
| A | 0.085 | 0.082 | 0.075 | 0.071 | 0.065 | 0.058 | 0.057 | 0.067 |
| Độ màu | 175 | 169 | 158 | 149 | 138 | 126 | 124 | 141 |
| HM% | 71.13 | 72.05 | 73.89 | 75.42 | 77.26 | 79.24 | 79.57 | 76.77 |
| pHsau | 4.54 | 4.58 | 4.68 | 4.71 | 4.72 | 4.75 | 4.78 | 4.7 |
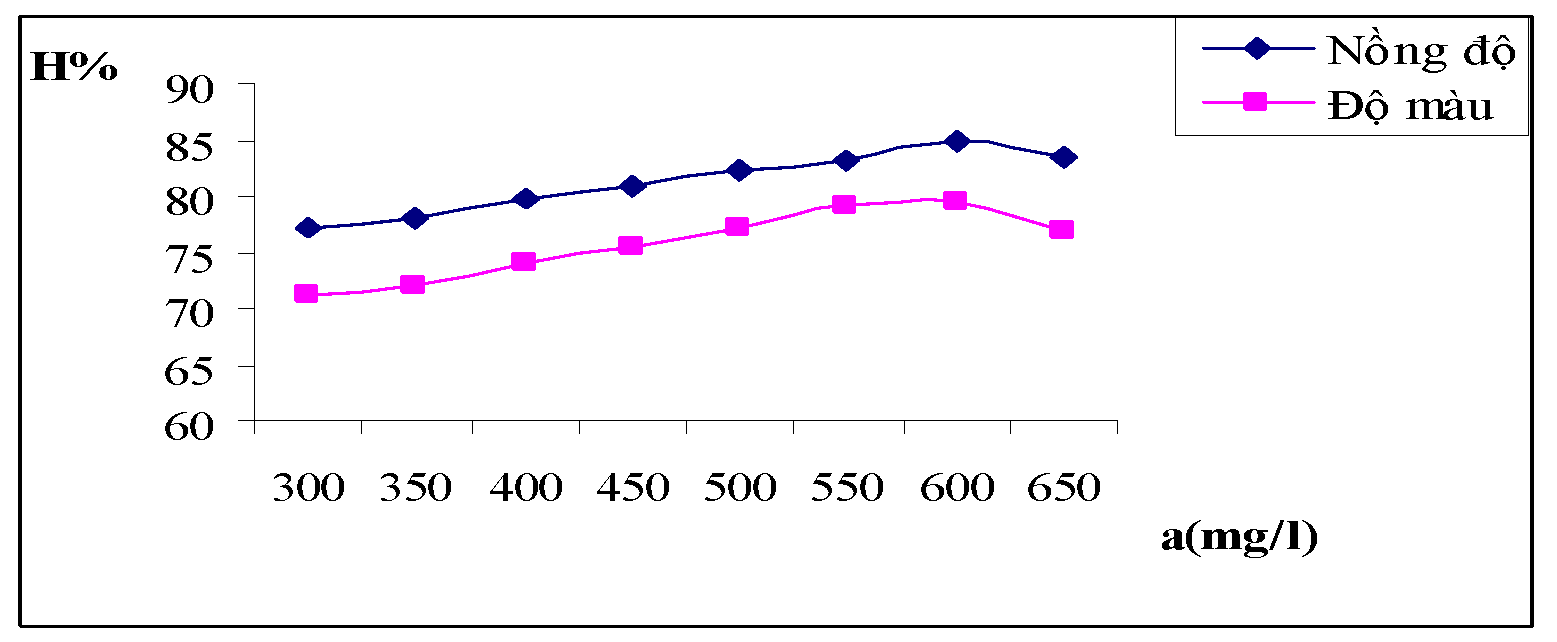 Hình 3.1. Đồ thị biễu diễn ảnh hưởng nồng độ chất keo tụ đối với hiệu suất về nồng độ và độ màu của nước thải
Hình 3.1. Đồ thị biễu diễn ảnh hưởng nồng độ chất keo tụ đối với hiệu suất về nồng độ và độ màu của nước thải
Nhận xét: Nồng độ chất keo tụ là một trong những yếu tố có tác động trực tiếp đến chất lượng của nước sau khi xử lý. Từ bảng số liệu thực nghiệm và đồ thị trên ta có thể thấy với nồng độ chất keo tụ trong khoảng 500 đến 600mg/l là cho hiệu quả xử lý tối ưu nhất.
3.1.1.2. Kết quả ảnh hưởng của liều lượng chất keo tụ
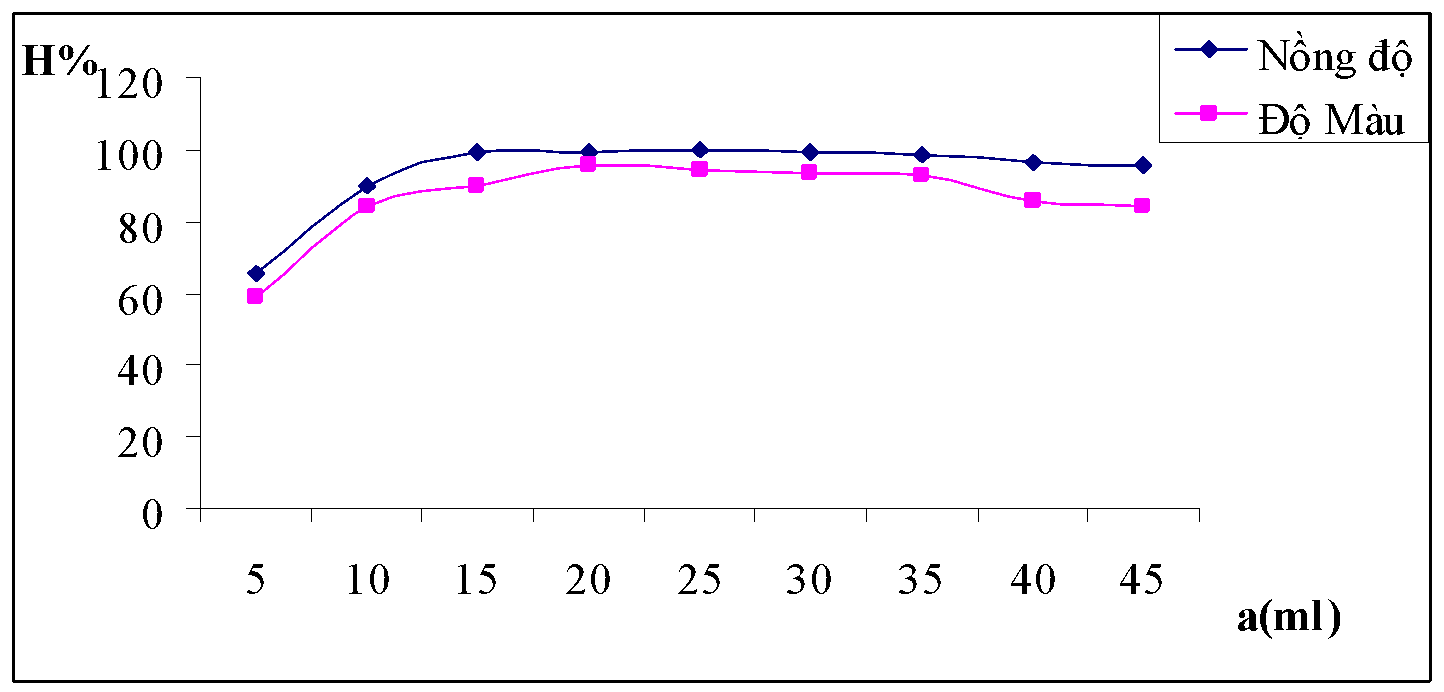
Bảng 3.2. Kết quả ảnh hưởng của liều lượng chất keo tụ
| a(ml) | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| A | 0.341 | 0.320 | 0.292 | 0.262 | 0.250 | 0.241 | 0.240 | 0.221 | 0.242 |
| HC% | 80.29 | 81.53 | 83.20 | 84.97 | 85.69 | 86.22 | 86.28 | 87.41 | 86.17 |
| A | 0.062 | 0.060 | 0.059 | 0.057 | 0.053 | 0.051 | 0.050 | 0.048 | 0.053 |
| Độ màu | 132 | 129 | 126 | 124 | 117 | 113 | 111 | 108 | 115 |
| HM% | 78.18 | 78.80 | 79.40 | 79.57 | 80.64 | 81.25 | 81.56 | 82.17 | 81.05 |
| pHsau | 4.7 | 4.74 | 4.71 | 4.78 | 4.8 | 4.81 | 4.8 | 4.83 | 4.82 |
Hình 3.2. Đồ thị biểu diễn ảnh hưởng liều lượng chất keo tụ đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Từ đồ thị suy ra liều lượng phèn tối ưu cần tìm là 40ml, khi thể tích phèn nhỏ hơn 40ml thì hiệu quả của quá trình keo tụ không cao lắm do lượng phèn chưa đủ nên số lượng hạt keo tạo thành không đủ để lôi cuốn tất cả các hạt huyền phù trong nước. Khi lượng phèn lớn hơn 40ml thì hiệu quả xử lý ngược lại
3.1.1.3. Kết quả ảnh hưởng của pH
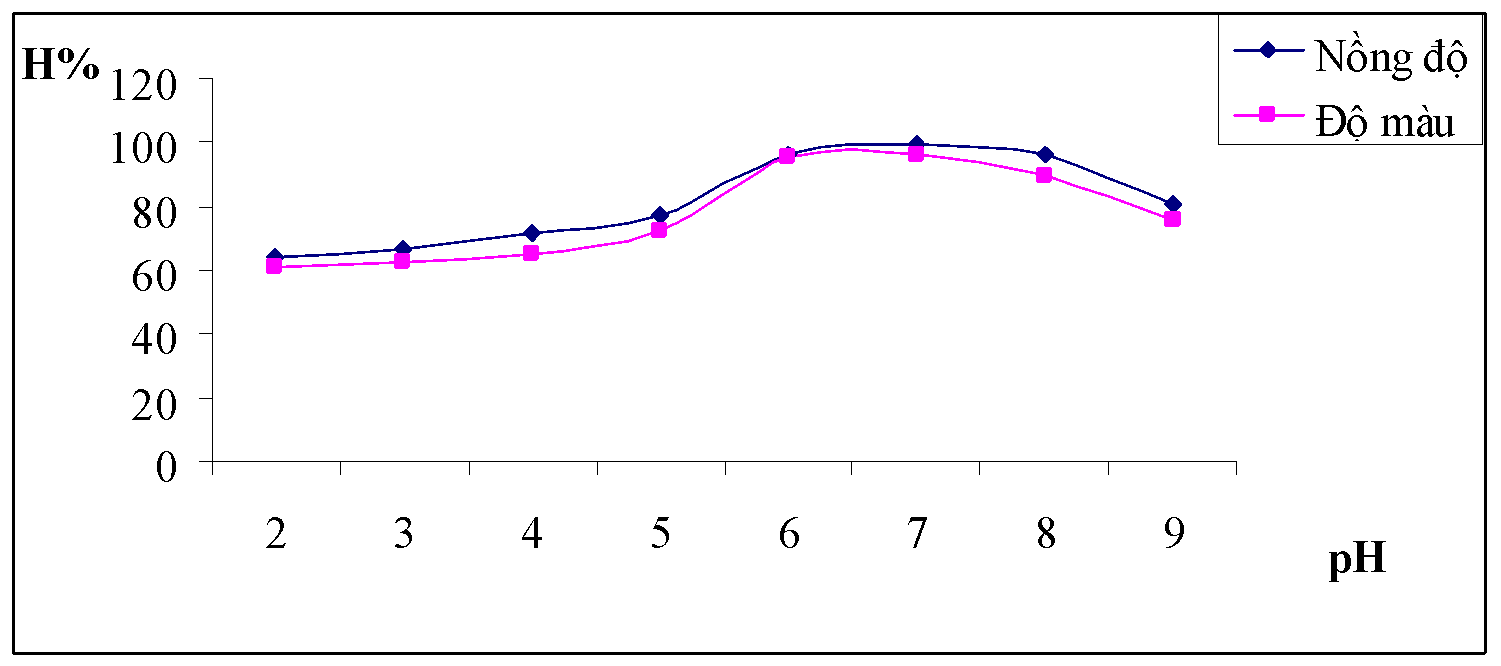
Bảng 3.3. Kết quả ảnh hưởng của pH
| pH | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | 0.582 | 0.553 | 0.491 | 0.382 | 0.198 | 0.141 | 0.162 | 0.202 |
| HC% | 65.97 | 67.69 | 71.38 | 77.85 | 88.78 | 92.16 | 90.92 | 88.54 |
| A | 0.175 | 0.153 | 0.138 | 0.096 | 0.054 | 0.032 | 0.05 | 0.059 |
| Độ màu | 343 | 302 | 275 | 195 | 119 | 77 | 110 | 126 |
| HM% | 43.49 | 50.25 | 54.69 | 67.87 | 80.34 | 87.38 | 81.86 | 79.10 |
| pHsau | 1.69 | 3.02 | 3.66 | 4.15 | 4.83 | 5.08 | 5.18 | 5.69 |
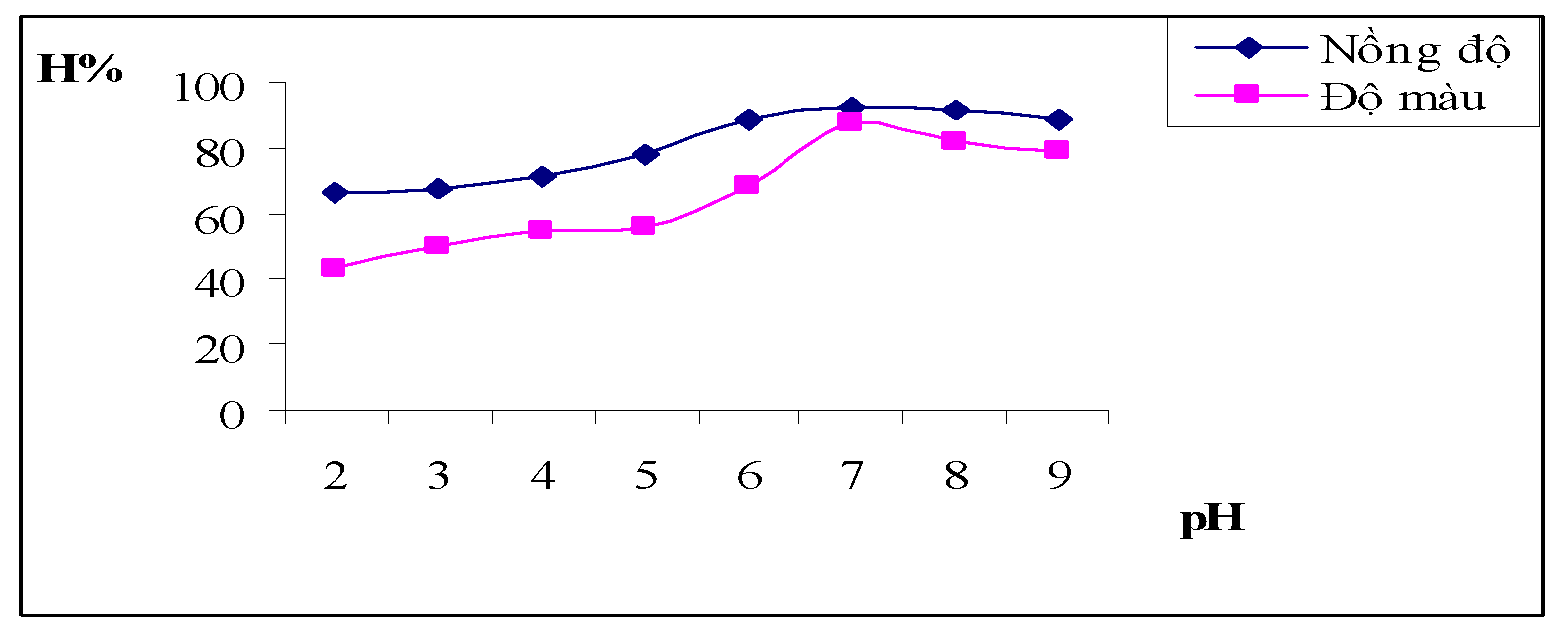
Hình 3.3. Đồ thị biểu diễn ảnh hưởng pH đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Qua bảng số liệu và đồ thị ta có thể thấy khoảng pH tốt nhất là khoảng 6-7.5 cho hiệu quả xử lý tối ưu nhất với những điều kiện như trên độ màu sau xử lý giảm có màu hồng nhạt và trong.
3.1.1.4. Kết quả ảnh hưởng của thời gian khuấy nhanh
Bảng 3.4. Kết quả ảnh hưởng của thời gian khuấy nhanh
| t(phút) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A | 0.141 | 0.120 | 0.154 | 0.162 | 0.202 | 0.230 | 0.279 |
| HC% | 92.16 | 93.41 | 91.39 | 90.92 | 88.54 | 86.88 | 83.97 |
| A | 0.032 | 0.029 | 0.031 | 0.032 | 0.034 | 0.038 | 0.049 |
| Độ màu | 77 | 72 | 75 | 77 | 82 | 88 | 109 |
| HM% | 87.38 | 88.14 | 87.64 | 87.38 | 86.49 | 85.50 | 82.04 |
| pHsau | 5.08 | 5.12 | 5.10 | 5.09 | 5.07 | 5.04 | 5.06 |
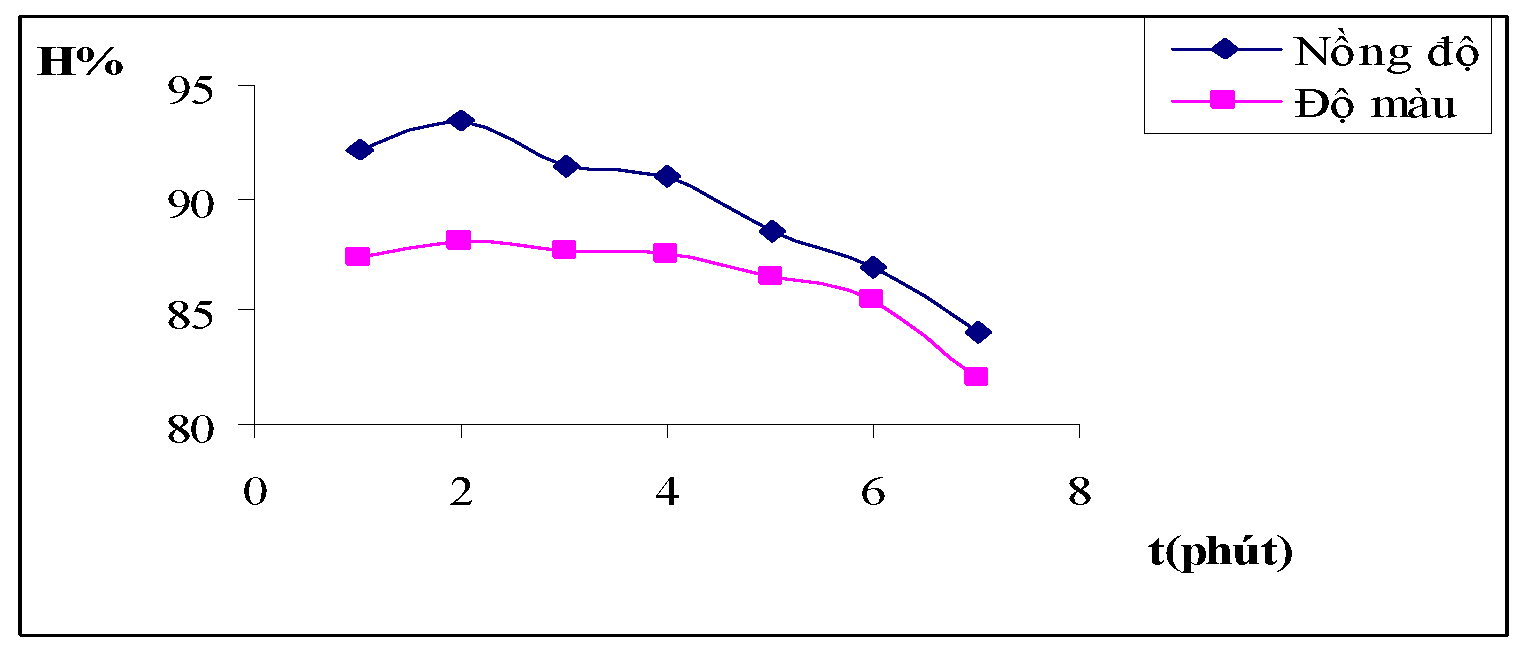
Hình 3.4. Đồ thị biểu diễn ảnh hưởng thời gian khuấy nhanh đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Qua bảng số thiệu trên có thể nhận thấy thời gian khuấy nhanh trong khoảng từ 1 phút đến 3 phút ít ảnh hưởng đến khả năng xử lý của quá trình keo tụ, mà chỉ ảnh hưởng đến bông keo tạo thành.
3.1.1.5. Kết quả ảnh hưởng của thời gian khuấy chậm
Bảng 3.5. Kết quả ảnh hưởng của thời gian khuấy chậm
| t(phút) | 2 | 4 | 6 | 8 | 10 | 12 |
| A | 0.132 | 0.120 | 0.118 | 0.114 | 0.130 | 0.152 |
| HC% | 92.70 | 93.41 | 93.53 | 93.77 | 92.82 | 91.51 |
| A | 0.032 | 0.029 | 0.026 | 0.025 | 0.027 | 0.031 |
| Độ màu | 76 | 72 | 66 | 63 | 67 | 74 |
| HM% | 87.48 | 88.14 | 89.13 | 89.62 | 88.96 | 87.81 |
| pHsau | 5.04 | 5.12 | 5.16 | 5.25 | 5.21 | 5.20 |
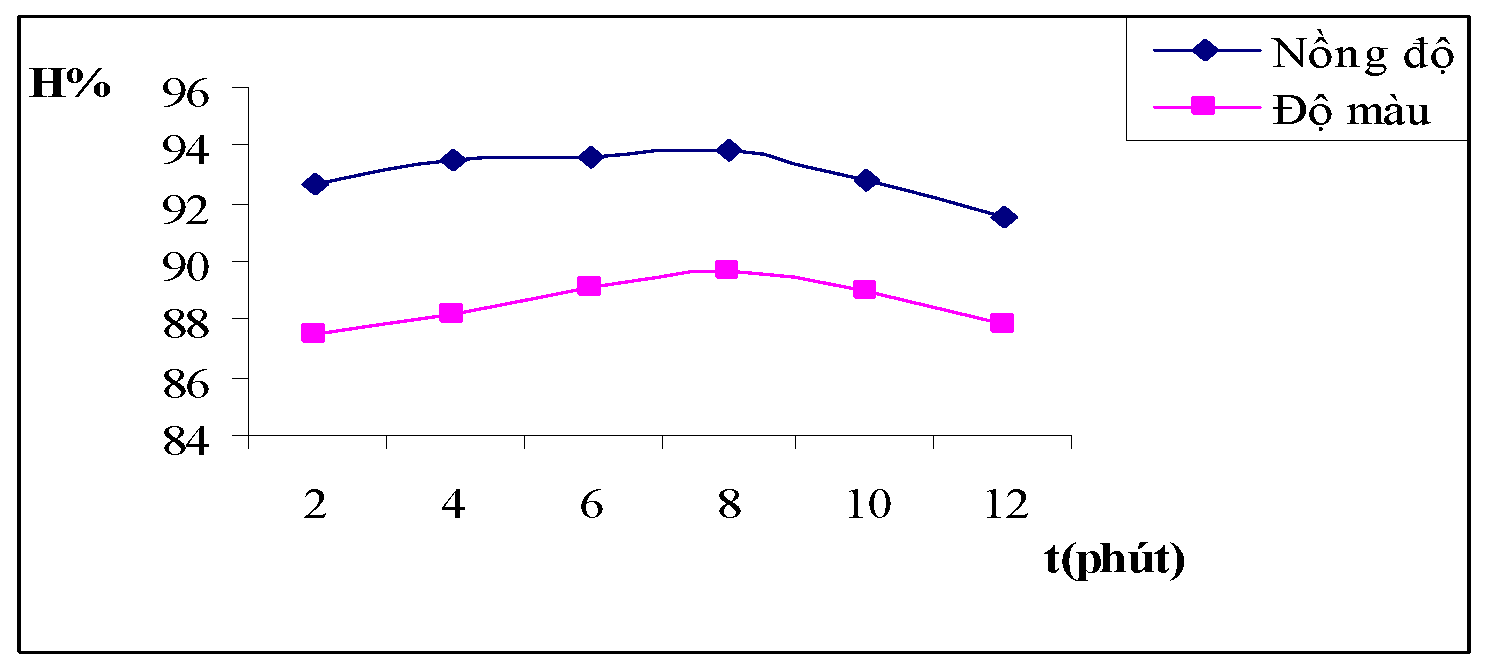
Hình 3.5. Đồ thị biểu diễn ảnh hưởng thời gian khuấy chậm đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Quá trình khuấy chậm có tác dụng làm cho các bông keo liên kết lại với nhau để tạo ra bông có nhiều hơn. Qua bảng số liệu và đồ thị ta thấy trong khoảng thời gian từ 4 phút đến 10 phút thì quá trình khuấy nhẹ ít ảnh hưởng đến quá trình keo tụ nhất.
3.1.1.6. Kết quả ảnh hưởng của nồng độ chất trợ keo tụ
Bảng 3.6. Kết quả ảnh hưởng của nồng độ chất trợ keo tụ
| a trợ(mg/l) | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| A | 0.211 | 0.169 | 0.161 | 0.141 | 0.114 | 0.102 | 0.121 |
| HC% | 88.01 | 90.50 | 90.98 | 92.16 | 93.77 | 94.48 | 93.35 |
| A | 0.037 | 0.035 | 0.032 | 0.029 | 0.024 | 0.020 | 0.025 |
| Độ màu | 86 | 83 | 78 | 72 | 63 | 54 | 64 |
| HM% | 85.83 | 86.33 | 87.15 | 88.14 | 89.62 | 91.10 | 89.46 |
| pHsau | 5.09 | 5.11 | 5.16 | 5.19 | 5.25 | 5.34 | 5.29 |
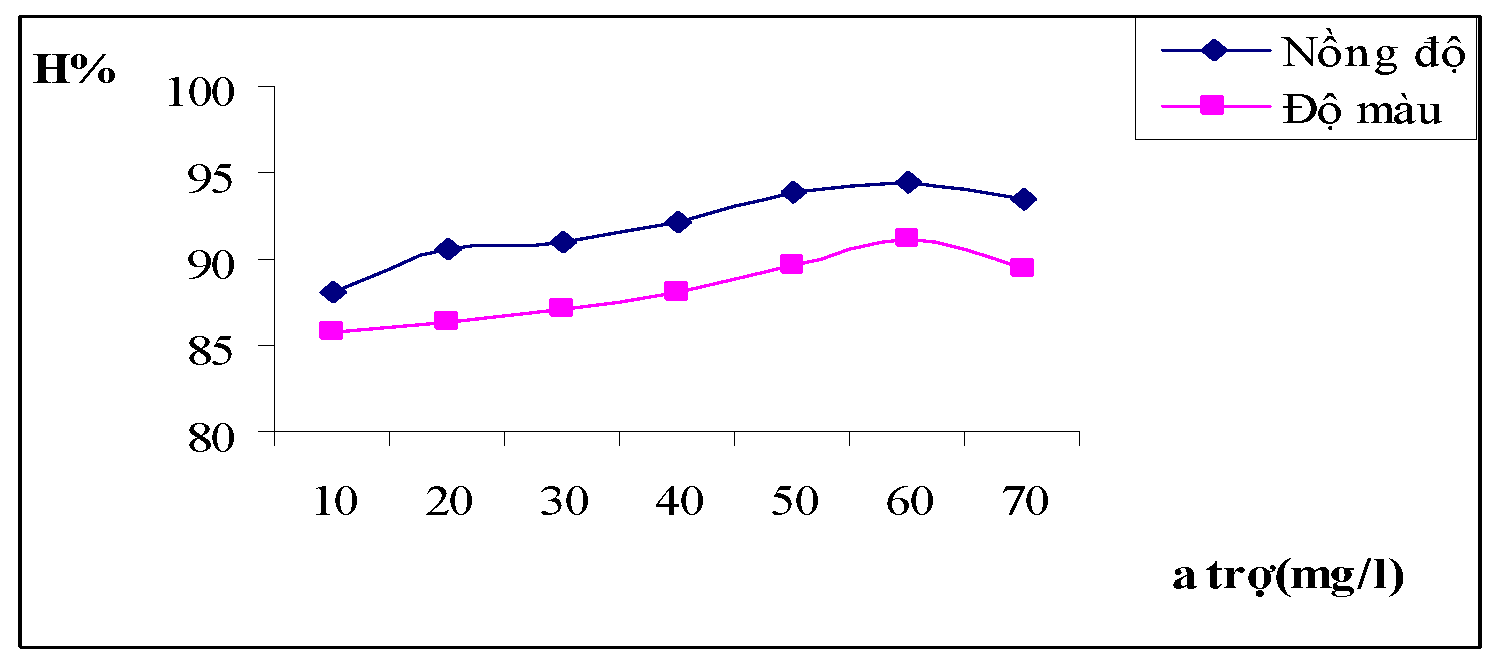
Hình 3.6. Đồ thị biểu diễn ảnh hưởng nồng độ chất trợ keo tụ đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét : Khi cho thêm chất trợ keo tụ vào nước sau khi thêm phèn nó sẽ làm tăng nhanh hiệu quả tạo bông. Đặc biệt với lượng chất trợ keo khoảng 40mg/l đến 60mg/l thì quá trình hình thành các bông keo rất nhanh, nước giảm độ màu một cách rõ rệt.
3.1.1.7. Kết quả ảnh hưởng của liều lượng chất trợ keo tụ
Bảng 3.7. Kết quả ảnh hưởng của liều lượng chất trợ keo tụ
| a trợ(ml) | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 | 0.12 | 0.14 |
| A | 0.229 | 0.198 | 0.181 | 0.139 | 0.102 | 0.098 | 0.131 |
| HC% | 86.99 | 88.78 | 89.79 | 92.28 | 94.48 | 94.72 | 92.76 |
| A | 0.035 | 0.033 | 0.030 | 0.029 | 0.020 | 0.019 | 0.028 |
| Độ màu | 84 | 78 | 73 | 71 | 54 | 52 | 69 |
| HM% | 86.16 | 87.14 | 87.97 | 88.30 | 91.10 | 91.43 | 88.63 |
| pHsau | 5.12 | 5.17 | 5.23 | 5.29 | 5.34 | 5.46 | 5.37 |
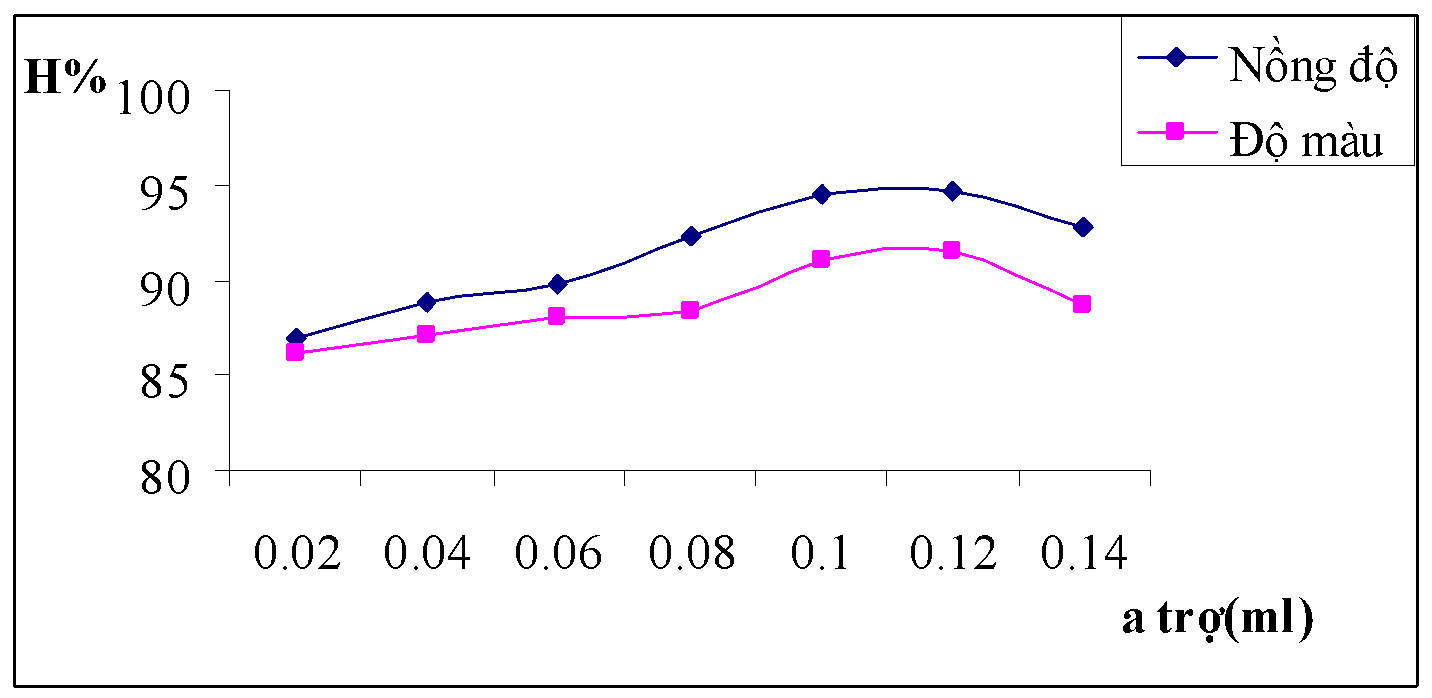
Hình 3.7. Đồ thị biểu diễn ảnh hưởng liều lượng chất trợ keo tụ đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Với những điều kiện số liệu thực nghiệm ở trên thì liều lượng chất trợ keo tụ sử dụng trong khoảng 0.1ml đến 0.12ml cho hiệu quả xử lý tối ưu nhất.
3.1.2. Kết quả xử lý nước thải bằng phèn PAC
3.1.2.1. Kết quả ảnh hưởng của nồng độ chất keo tụ
Bảng 3.8. Kết quả ảnh hưởng của nồng độ chất keo tụ
| a(mg/l) | 300 | 350 | 400 | 450 | 500 | 550 | 600 | 650 |
| A | 0.199 | 0.066 | 0.037 | 0.025 | 0.022 | 0.019 | 0.028 | 0.065 |
| HC% | 88.72 | 96.62 | 98.34 | 99.05 | 99.23 | 99.41 | 98.87 | 96.67 |
| A | 0.051 | 0.035 | 0.019 | 0.013 | 0.010 | 0.005 | 0.007 | 0.008 |
| Độ màu | 113 | 82 | 52 | 41 | 35 | 26 | 30 | 32 |
| HM% | 81.25 | 86.49 | 91.41 | 93.21 | 94.23 | 95.72 | 95.06 | 94.73 |
| pHsau | 5.02 | 5.08 | 5.1 | 5.26 | 5.42 | 5.53 | 5.51 | 5.48 |
Hình 3.8. Đồ thị biểu diễn ảnh hưởng nồng độ chất trợ keo tụ đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Nồng độ chất keo tụ là một trong những yếu tố có tác động trực tiếp đến chất lượng của nước sau khi xử lý. Từ bảng số liệu thực nghiệm và đồ thị trên ta có thể thấy với nồng độ chất keo tụ trong khoảng 450 đến 550mg/l là cho hiệu quả xử lý tối ưu nhất.
3.1.2.2. Kết quả ảnh hưởng của liều lượng chất keo tụ
Bảng 3.9. Kết quả ảnh hưởng của liều lượng chất keo tụ
| a(ml) | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| A | 0.951 | 0.204 | 0.029 | 0.019 | 0.015 | 0.019 | 0.047 | 0.061 | 0.079 |
| HC% | 65.57 | 89.92 | 98.81 | 99.52 | 99.64 | 99.41 | 98.12 | 96.91 | 95.84 |
| A | 0.125 | 0.043 | 0.030 | 0.005 | 0.009 | 0.011 | 0.015 | 0.039 | 0.043 |
| Độ màu | 250 | 97 | 61 | 26 | 34 | 38 | 45 | 89 | 97 |
| HM% | 58.81 | 84.01 | 89.97 | 95.72 | 94.44 | 93.47 | 92.58 | 85.34 | 84.01 |
| pHsau | 5.21 | 5.29 | 5.34 | 5.53 | 5.33 | 5.3 | 5.29 | 5.19 | 5.17 |
Hình 3.9. Đồ thị biểu diễn ảnh hưởng liều lượng chất keo tụ đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Từ đồ thị suy ra liều lượng phèn tối ưu cần tìm là 20ml, khi thể tích phèn nhỏ hơn 20ml thì hiệu quả của quá trình keo tụ không cao lắm do lượng phèn chưa đủ nên số lượng hạt keo tạo thành không đủ để lôi cuốn tất cả các hạt huyền phù trong nước. Khi lượng phèn lớn hơn 20ml thì hiệu quả xử lý ngược lại.
3.1.2.3. Kết quả ảnh hưởng của pH
Bảng 3.10. Kết quả ảnh hưởng của pH
| pH | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | 0.731 | 0.643 | 0.589 | 0.480 | 0.074 | 0.072 | 0.326 | 0.391 |
| HC% | 64.12 | 66.98 | 71.23 | 77.56 | 96.15 | 99.52 | 96.23 | 80.21 |
| A | 0.12 | 0.099 | 0.088 | 0.075 | 0.005 | 0.003 | 0.045 | 0.125 |
| Độ màu | 240 | 201 | 181 | 156 | 26 | 23 | 101 | 250 |
| HM% | 60.46 | 62.12 | 65.17 | 72.23 | 95.71 | 96.21 | 89.56 | 75.55 |
| pHsau | 1.89 | 3.21 | 3.54 | 3.93 | 5.53 | 6.29 | 6.55 | 7.61 |
Hình 3.10. Đồ thị biểu diễn ảnh hưởng pH đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Qua bảng số liệu và đồ thị ta có thể thấy khoảng pH tốt nhất là khoảng 6-8 cho hiệu quả xử lý tối ưu nhất với những điều kiện như trên độ màu sau xử lý giảm có màu hồng nhạt và trong.
3.1.2.4. Kết quả ảnh hưởng của thời gian khuấy nhanh
Bảng 3.11. Kết quả ảnh hưởng của thời gian khuấy nhanh
| t(phút) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A | 0.012 | 0.014 | 0.013 | 0.015 | 0.022 | 0.023 | 0.025 |
| HC% | 99.82 | 99.70 | 99.76 | 99.64 | 99.23 | 99.17 | 99.05 |
| A | 0.003 | 0.004 | 0.006 | 0.009 | 0.010 | 0.013 | 0.017 |
| Độ màu | 23 | 25 | 28 | 34 | 35 | 41 | 48 |
| HM% | 96.21 | 95.88 | 94.72 | 94.39 | 94.23 | 93.24 | 92.09 |
| pHsau | 6.29 | 6.24 | 6.19 | 6.17 | 6.15 | 6.12 | 6.08 |
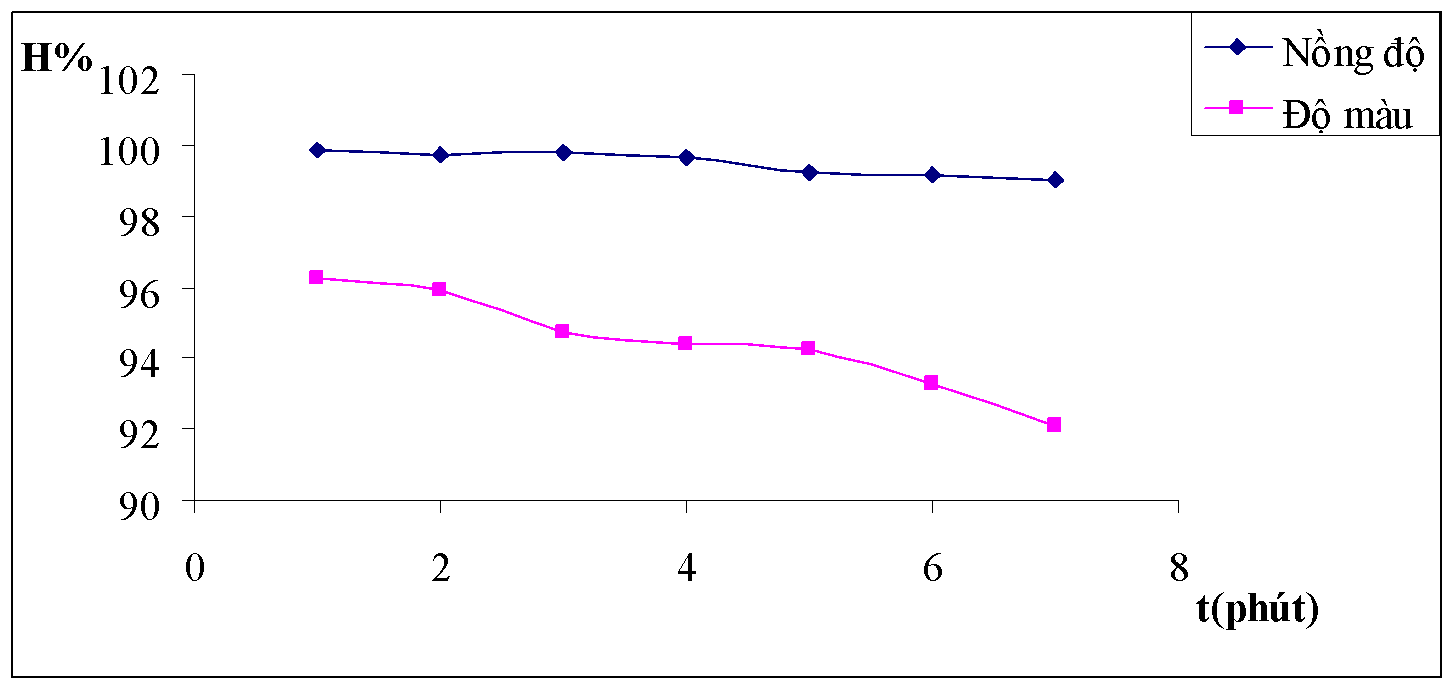
Hình 3.11. Đồ thị biểu diễn ảnh hưởng của thời gian khuấy nhanh đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Qua bảng số liệu trên có thể nhận thấy thời gian khuấy nhanh trong khoảng từ 1 phút đến 2 phút ít ảnh hưởng đến khả năng xử lý của quá trình keo tụ, mà chỉ ảnh hưởng đến bông keo tạo thành.
3.1.2.5. Kết quả ảnh hưởng của thời gian khuấy chậm
Bảng 3.12. Kết quả ảnh hưởng của thời gian khuấy chậm
| t(phút) | 2 | 4 | 6 | 8 | 10 | 12 |
| A | 0.037 | 0.015 | 0.018 | 0.017 | 0.019 | 0.020 |
| HC% | 98.34 | 99.65 | 99.47 | 99.53 | 99.41 | 99.35 |
| A | 0.008 | 0.003 | 0.005 | 0.006 | 0.007 | 0.009 |
| Độ màu | 32 | 23 | 27 | 28 | 29 | 34 |
| HM% | 94.75 | 96.21 | 95.55 | 95.38 | 95.22 | 94.39 |
| PHs | 6.29 | 6.31 | 6.27 | 6.23 | 6.19 | 6.15 |
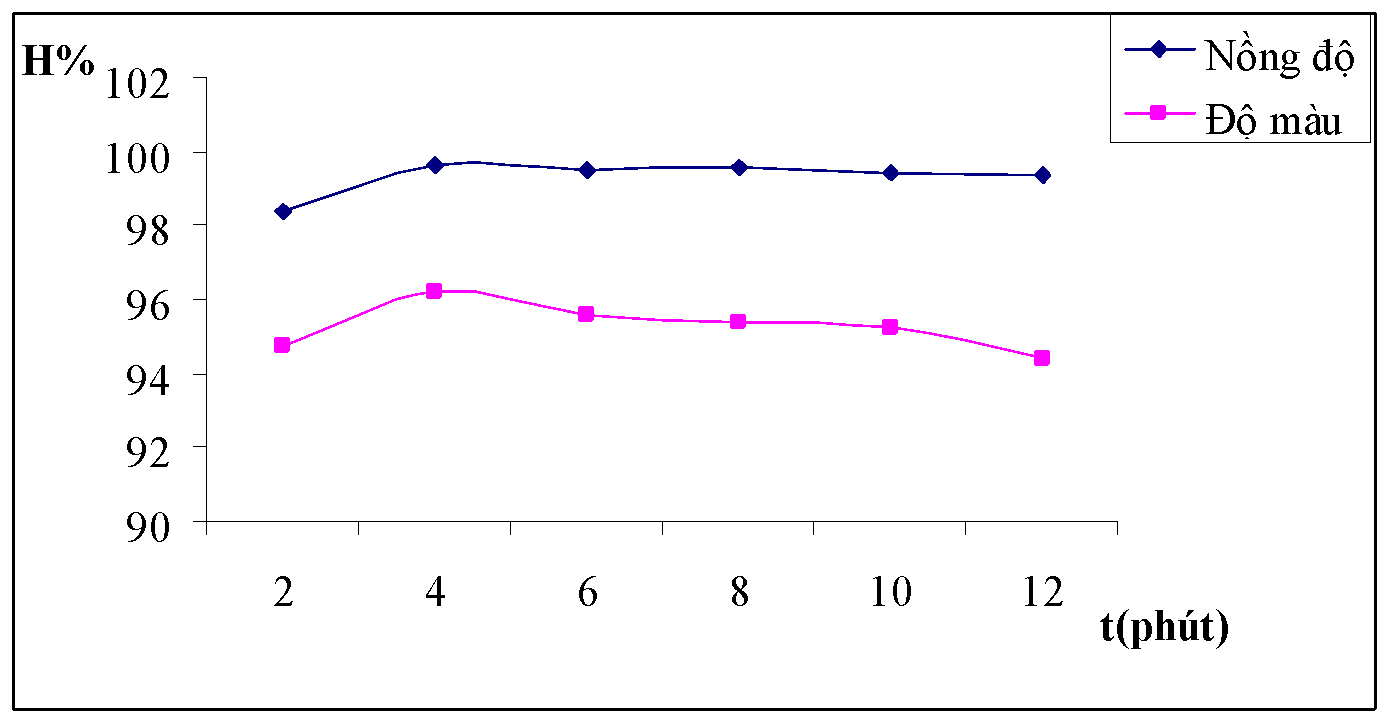
Hình 3.12. Đồ thị biểu diễn ảnh hưởng của thời gian khuấy chậm đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Quá trình khuấy chậm có tác dụng làm cho các bông keo liên kết lại với nhau để tạo ra bông có nhiều hơn. Qua bảng số liệu và đồ thị ta thấy trong khoảng thời gian từ 4 phút đến 8 phút thì quá trình khuấy nhẹ ít ảnh hưởng đến quá trình keo tụ nhất.
3.1.2.6. Kết quả ảnh hưởng của nồng độ chất trợ keo tụ
Bảng 3.13. Kết quả ảnh hưởng của nồng độ chất trợ keo tụ
| a trợ(mg/l) | 10 | 20 | 30 | 40 | 50 | 60 |
| A | 0.089 | 0.025 | 0.022 | 0.016 | 0.012 | 0.03 |
| HC% | 95.26 | 99.05 | 99.23 | 99.59 | 99.82 | 98.76 |
| A | 0.033 | 0.042 | 0.037 | 0.010 | 0.003 | 0.009 |
| Độ màu | 95 | 78 | 65 | 35 | 23 | 34 |
| HM% | 84.32 | 87.08 | 89.26 | 94.23 | 96.21 | 94.39 |
| pHsau | 6.03 | 6.09 | 6.13 | 6.27 | 6.31 | 6.25 |
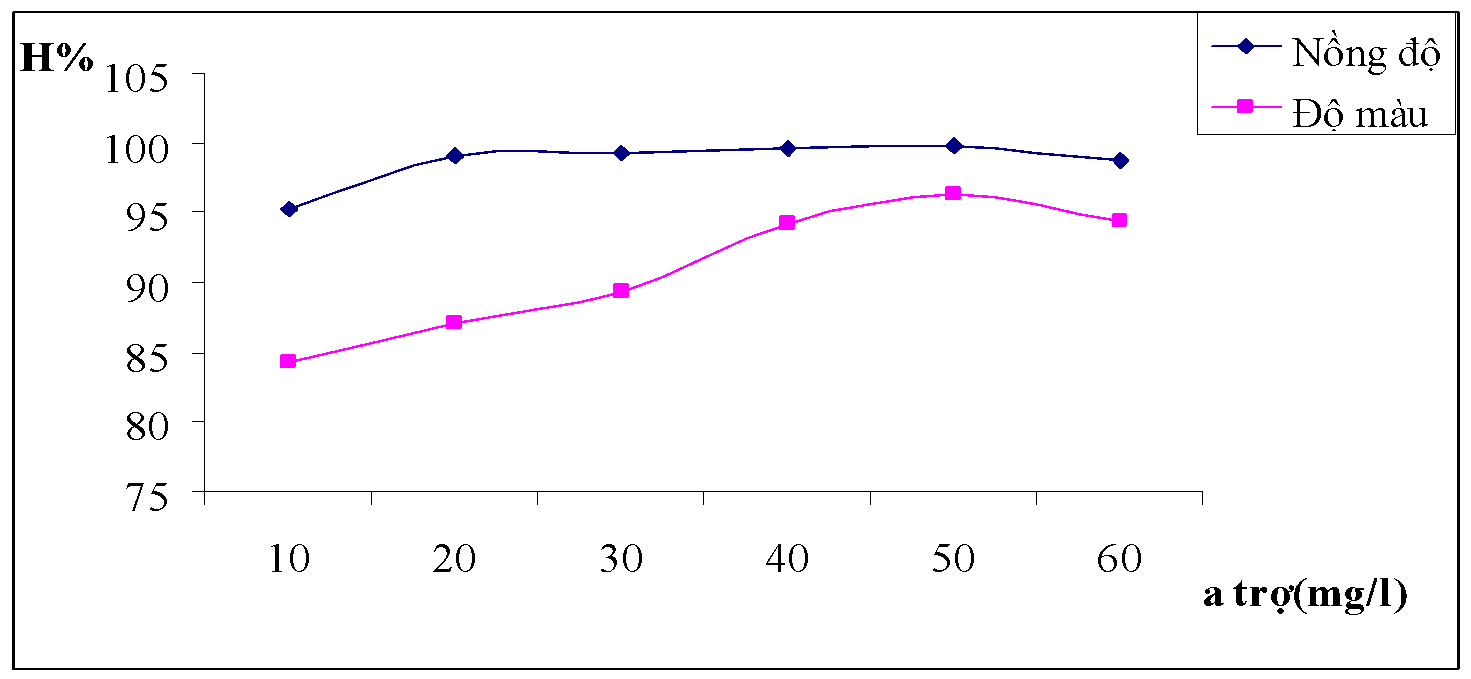
Hình 3.13. Đồ thị biểu diễn ảnh hưởng của nồng độ chất trợ keo tụ đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét : Khi cho thêm chất trợ keo tụ vào nước sau khi thêm phèn nó sẽ làm tăng nhanh hiệu quả tạo bông. Đặc biệt với lượng chất trợ keo khoảng 30mg/l đến 50mg/l thì quá trình hình thành các bông keo rất nhanh, nước giảm độ màu một cách rõ rệt.
3.1.2.7. Kết quả ảnh hưởng của liều lượng chất trợ keo tụ
Bảng 3.14. Kết quả ảnh hưởng của liều lượng chất trợ keo tụ
| a trợ(ml) | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 | 0.12 | 0.14 |
| A | 0.021 | 0.013 | 0.012 | 0.020 | 0.014 | 0.014 | 0.022 |
| HC% | 99.29 | 99.76 | 99.82 | 99.35 | 99.71 | 99.71 | 99.23 |
| A | 0.004 | 0.004 | 0.001 | 0.002 | 0.003 | 0.006 | 0.007 |
| Độ màu | 26 | 26 | 19 | 21 | 23 | 29 | 31 |
| HM% | 95.72 | 95.72 | 96.87 | 96.54 | 96.21 | 95.22 | 94.89 |
| pHsau | 6.33 | 6.33 | 6.41 | 6.37 | 6.31 | 6.29 | 6.23 |
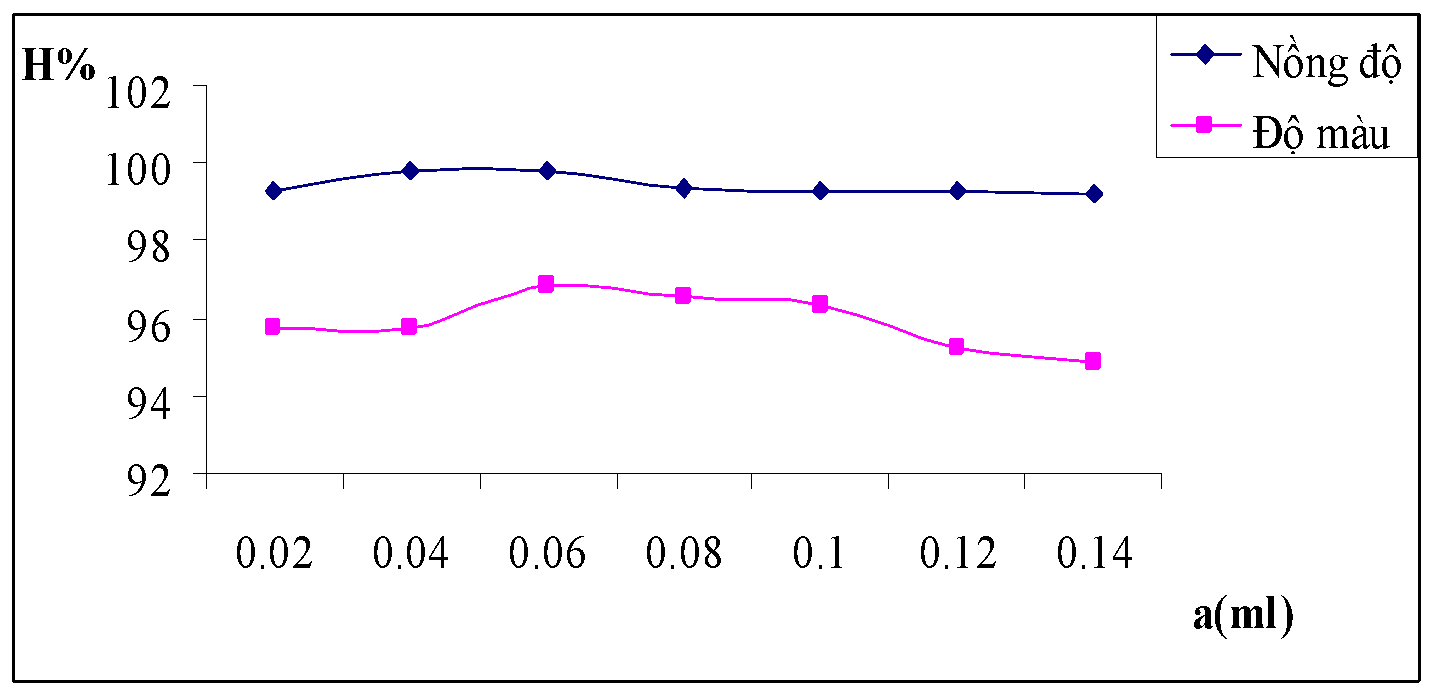
Hình 3.14. Đồ thị biểu diễn ảnh hưởng của liều lượng đối với hiệu suất của nồng độ và độ màu nước thải
Nhận xét: Với những điều kiện số liệu thưc nghiệm ở trên thì liều lượng chất trợ keo tụ sử dụng trong khoảng 0.02ml đến 0.06ml cho hiệu quả xử lý tối ưu nhất.
3.1.3. So sánh kết quả xử lý nước thải giả định thuốc nhuộm Sumifix Red – S2B của phèn kali nhôm sunfat và phèn PAC
Bảng 3.15. Kết quả xử lý nước thải giả định thuốc nhuộm Sumifix Red – S2B của phèn kali nhôm sunfat và phèn PAC
| Thông số tối ưu |
Phèn
kali nhôm sunfat |
Phèn
PAC |
| Nồng độ a(mg/l) | 600 | 550 |
| Liều lượng a(ml) | 40 | 20 |
| pH | 7 | 7 |
| Khuấy nhanh | 2 | 1 |
| Khuấy chậm | 8 | 6 |
| Nồng độ a trợ(mg/l) | 60 | 50 |
| Liều lượng a trợ(ml) | 0.12 | 0.06 |
| HC% | 94.72 | 99.82 |
| HM% | 91.43 | 96.54 |
3.2. Kết quả xứ lý nước thải công ty TNHH Samil Vina Long Thành
3.2.1. Kết quả xử lý nước thải bằng phèn kali nhôm sunfat
3.2.1.1. Kết quả ảnh hưởng của nồng độ chất keo tụ
Bảng 3.16. Kết quả ảnh hưởng của nồng độ chất keo tụ
| a(g/l) | 600 | 650 | 700 | 750 | 800 | 850 | 900 |
| A | 0.120 | 0.112 | 0.106 | 0.104 | 0.103 | 0.094 | 0.097 |
| Độ màu | 240 | 225 | 214 | 211 | 209 | 192 | 197 |
| HM% | 78.40 | 79.74 | 80.74 | 81.08 | 81.24 | 82.75 | 82.30 |
| pHsau | 5.27 | 5.33 | 5.41 | 5.49 | 5.53 | 5.67 | 5.58 |
Nhận xét: Nồng độ chất keo tụ là một trong những yếu tố có tác động trực tiếp đến chất lượng của nước sau khi xử lý. Từ bảng số liệu thực nghiệm và đồ thị trên ta có thể thấy với nồng độ chất keo tụ trong khoảng 750 đến 850mg/l là cho hiệu quả xử lý tối ưu nhất.
3.2.1.2. Kết quả ảnh hưởng của liều lượng chất keo tụ
Bảng 3.17. Kết quả ảnh hưởng của liều lượng chất keo tụ
| a(ml) | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
| A | 0.115 | 0.113 | 0.094 | 0.100 | 0.105 | 0.112 | 0.113 |
| Độ màu | 231 | 227 | 192 | 203 | 212 | 225 | 227 |
| HM% | 79.24 | 79.57 | 82.75 | 81.75 | 80.91 | 79.74 | 79.57 |
| pHsau | 5.54 | 5.61 | 5.67 | 5.59 | 5.46 | 5.38 | 5.26 |
Nhận xét: Từ đồ thị suy ra liều lượng phèn tối ưu cần tìm là 40ml, khi thể tích phèn nhỏ hơn 40ml thì hiệu quả của quá trình keo tụ không cao lắm do lượng phèn chưa đủ nên số lượng hạt keo tạo thành không đủ để lôi cuốn tất cả các hạt huyền phù trong nước. Khi lượng phèn lớn hơn 40ml thì hiệu quả xử lý ngược lại.
3.2.1.3. Kết quả ảnh hưởng của pH
Bảng 3.18. Kết quả ảnh hưởng của pH
| pH | 5 | 6 | 7 | 8 | 9 | 10 |
| A | 0.135 | 0.124 | 0.094 | 0.101 | 0.122 | 0.148 |
| Độ màu | 268 | 248 | 192 | 205 | 244 | 293 |
| HM% | 75.89 | 77.72 | 82.75 | 81.58 | 78.07 | 73.72 |
| pHsau | 4.05 | 4.47 | 5.67 | 5.60 | 5.82 | 6.7 |
Nhận xét: Qua bảng số liệu và đồ thị ta có thể thấy khoảng pH tốt nhất là khoảng 6-7 cho hiệu quả xử lý tối ưu nhất với những điều kiện như trên độ màu sau xử lý giảm có màu nâu nhạt và trong.
3.2.1.4. Kết quả ảnh hưởng của thời gian khuấy nhanh
Bảng 3.19. Kết quả ảnh hưởng của thời gian khuấy nhanh
| t (phút) | 2 | 3 | 4 | 5 | 6 | 7 |
| A | 0.094 | 0.092 | 0.090 | 0.087 | 0.085 | 0.093 |
| Độ màu | 192 | 188 | 185 | 178 | 175 | 190 |
| HM% | 82.75 | 83.10 | 83.40 | 83.92 | 84.25 | 82.92 |
| pHsau | 5.67 | 5.62 | 5.64 | 5.72 | 5.74 | 5.46 |
Nhận xét: Qua bảng số liệu trên có thể nhận thấy thời gian khuấy nhanh trong khoảng từ 4 phút đến 6 phút ít ảnh hưởng đến khả năng xử lý của quá trình keo tụ, mà chỉ ảnh hưởng đến bông keo tạo thành.
3.2.1.5. Kết quả ảnh hưởng của thời gian khuấy chậm
Bảng 3.20. Kết quả ảnh hưởng của thời gian khuấy chậm
| t(phút) | 6 | 8 | 10 | 12 | 14 | 16 |
| A | 0.085 | 0.082 | 0.078 | 0.073 | 0.075 | 0.080 |
| Độ màu | 175 | 170 | 162 | 153 | 157 | 166 |
| HM% | 84.25 | 84.76 | 85.44 | 86.26 | 85.93 | 85.09 |
| pHsau | 5.74 | 5.62 | 5.58 | 5.76 | 5.51 | 5.46 |
Nhận xét: Quá trình khuấy chậm có tác dụng làm cho các bông keo liên kết lại với nhau để tạo ra bông có nhiều hơn. Qua bảng số liệu và đồ thị ta thấy trong khoảng thời gian từ 10 phút đến 14 phút thì quá trình khuấy nhẹ ít ảnh hưởng đến quá trình keo tụ nhất.
3.2.1.6. Kết quả ảnh hưởng của nồng độ chất trợ keo tụ
Bảng 3.21. Kết quả ảnh hưởng của nồng độ chất trợ keo tụ
| a trợ(mg/l) | 60 | 70 | 80 | 90 | 100 | 111 |
| A | 0.073 | 0.069 | 0.065 | 0.065 | 0.062 | 0.064 |
| Độ màu | 153 | 145 | 138 | 138 | 132 | 136 |
| HM% | 86.26 | 86.97 | 87.60 | 87.60 | 88.14 | 87.78 |
| pHsau | 5.76 | 5.73 | 5.64 | 5.64 | 5.78 | 5.67 |
Nhận xét : Khi cho thêm chất trợ keo tụ vào nước sau khi thêm phèn nó sẽ làm tăng nhanh hiệu quả tạo bông. Đặc biệt với lượng chất trợ keo khoảng 80mg/l đến 100mg/l thì quá trình hình thành các bông keo rất nhanh, nước giảm độ màu một cách rõ rệt.
3.2.1.7. Kết quả ảnh hưởng của liều lượng chất trợ keo tụ
Bảng 3.22. Kết quả ảnh hưởng của liều lượng chất trợ keo tụ
| a trợ(ml) | 0.12 | 0.14 | 0.16 | 0.18 | 0.20 | 0.22 |
| A | 0.062 | 0.06 | 0.056 | 0.058 | 0.061 | 0.064 |
| Độ màu | 132 | 129 | 121 | 125 | 131 | 136 |
| HM% | 88.14 | 88.44 | 89.11 | 88.77 | 88.27 | 87.77 |
| pHsau | 5.78 | 5.65 | 5.83 | 5.68 | 5.57 | 5.44 |
Nhận xét: Với những điều kiện số liệu thưc nghiệm ở trên thì liều lượng chất trợ keo tụ sử dụng trong khoảng 0.14ml đến 0.18ml cho hiệu quả xử lý tối ưu nhấ
3.2.2. Kết quả xử lý nước thải bằng phèn PAC
3.2.2.1. Kết quả ảnh hưởng của nồng độ chất keo tụ
Bảng 3.23. Kết quả ảnh hưởng của nồng độ chất keo tụ
| a(mg/l) | 550 | 600 | 650 | 700 | 750 | 800 | 850 | 900 |
| A | 0.079 | 0.067 | 0.053 | 0.045 | 0.038 | 0.030 | 0.037 | 0.042 |
| Độ màu | 164 | 142 | 116 | 101 | 88 | 73 | 86 | 95 |
| HM% | 85.26 | 87.24 | 89.58 | 90.92 | 92.10 | 93.44 | 92.27 | 91.46 |
| pHsau | 5.94 | 6.03 | 6.11 | 6.18 | 6.23 | 6.28 | 6.24 | 6.21 |
Nhận xét: Nồng độ chất keo tụ là một trong những yếu tố có tác động trực tiếp đến chất lượng của nước sau khi xử lý. Từ bảng số liệu thực nghiệm và đồ thị trên ta có thể thấy với nồng độ chất keo tụ trong khoảng 750 đến 850mg/l là cho hiệu quả xử lý tối ưu nhất.
3.2.2.2. Kết quả ảnh hưởng của liều lượng chất keo tụ
Bảng 3.24. Kết quả ảnh hưởng của liều lượng chất keo tụ
| a(ml) | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
| A | 0.030 | 0.026 | 0.029 | 0.033 | 0.035 | 0.041 | 0.044 |
| Độ màu | 73 | 65 | 71 | 78 | 82 | 93 | 99 |
| HM% | 93.44 | 94.16 | 93.62 | 92.99 | 92.63 | 91.64 | 91.10 |
| pHsau | 6.28 | 6.31 | 6.26 | 6.21 | 6.16 | 6.12 | 6.09 |
Nhận xét: Từ đồ thị suy ra liều lượng phèn tối ưu cần tìm là 25ml, khi thể tích phèn nhỏ hơn 25ml thì hiệu quả của quá trình keo tụ không cao lắm do lượng phèn chưa đủ nên số lượng hạt keo tạo thành không đủ để lôi cuốn tất cả các hạt huyền phù trong nước. Khi lượng phèn lớn hơn 25ml thì hiệu quả xử lý ngược lại.
3.2.2.3. Kết quả ảnh hưởng của pH
Bảng 3.25. Kết quả ảnh hưởng của pH
| pH | 5 | 6 | 7 | 8 | 9 | 10 |
| A | 0.041 | 0.035 | 0.026 | 0.040 | 0.065 | 0.094 |
| Độ màu | 93 | 82 | 65 | 91 | 138 | 192 |
| HM% | 91,61 | 92.63 | 94.16 | 91.82 | 87.60 | 82.75 |
| pHsau | 4.32 | 5.4 | 6.31 | 7.25 | 8.22 | 9.6 |
Nhận xét: Qua bảng số liệu và đồ thị ta có thể thấy khoảng pH tốt nhất là khoảng 6-8 cho hiệu quả xử lý tối ưu nhất với những điều kiện như trên độ màu sau xử lý giảm có màu nâu nhạt và trong
3.2.2.4. Kết quả ảnh hưởng của thời gian khuấy nhanh
Bảng 3.26. Kết quả ảnh hưởng của thời gian khuấy nhanh
| t (phút) | 2 | 3 | 4 | 5 | 6 | 7 |
| A | 0.024 | 0.023 | 0.021 | 0.029 | 0.034 | 0.043 |
| Độ màu | 62 | 60 | 56 | 70 | 80 | 97 |
| HM% | 94.46 | 94.62 | 94.96 | 93.62 | 92.81 | 91.28 |
| pHsau | 6.31 | 6.38 | 6.43 | 6.36 | 6.33 | 6.26 |
Nhận xét: Qua bảng số liệu trên có thể nhận thấy thời gian khuấy nhanh trong khoảng từ 2 phút đến 4 phút ít ảnh hưởng đến khả năng xử lý của quá trình keo tụ, mà chỉ ảnh hưởng đến bông keo tạo thành.
3.2.2.5. Kết quả ảnh hưởng của thời gian khuấy chậm
Bảng 3.27. Kết quả ảnh hưởng của thời gian khuấy chậm
| t (phút) | 4 | 6 | 8 | 10 | 12 | 14 |
| A | 0.021 | 0.020 | 0.018 | 0.017 | 0.024 | 0.031 |
| Độ màu | 56 | 54 | 50 | 49 | 62 | 75 |
| HM% | 94.96 | 95.13 | 95.30 | 95.63 | 94.46 | 93.29 |
| pHsau | 6.43 | 6.46 | 6.46 | 6.59 | 6.57 | 6.49 |
Nhận xét: Quá trình khuấy chậm có tác dụng làm cho các bông keo liên kết lại với nhau để tạo ra bông có nhiều hơn. Qua bảng số liệu và đồ thị ta thấy trong khoảng thời gian từ 6 phút đến 10 phút thì quá trình khuấy nhẹ ít ảnh hưởng đến quá trình keo tụ nhất.
3.2.2.6. Kết quả ảnh hưởng của nồng độ chất trợ keo tụ
Bảng 3.28. Kết quả ảnh hưởng của nồng độ chất trợ keo tụ
| a (trợ mg/l) | 50 | 60 | 70 | 80 | 90 | 100 |
| A | 0.017 | 0.016 | 0.014 | 0.018 | 0.020 | 0.024 |
| Độ màu | 49 | 47 | 43 | 51 | 54 | 62 |
| H% | 95.63 | 95.80 | 96.13 | 95.46 | 95.13 | 94.42 |
| pHsau | 6.59 | 6.63 | 6.72 | 6.69 | 6.65 | 6.57 |
Nhận xét : Khi cho thêm chất trợ keo tụ vào nước sau khi thêm phèn nó sẽ làm tăng nhanh hiệu quả tạo bông. Đặc biệt với lượng chất trợ keo khoảng 50mg/l đến 80mg/l thì quá trình hình thành các bông keo rất nhanh, nước giảm độ màu một cách rõ rệt.
3.2.2.7. Kết quả ảnh hưởng của liều lượng chất trợ keo
Bảng 3.29. Kết quả ảnh hưởng của liều lượng chất trợ keo tụ
| a (trợ ml) | 0.06 | 0.08 | 0.1 | 0.12 | 0.14 | 0.16 |
| A | 0.014 | 0.014 | 0.013 | 0.015 | 0.019 | 0.020 |
| Độ màu | 43 | 43 | 41 | 45 | 52 | 54 |
| HM% | 96.13 | 96.13 | 96.30 | 95.96 | 95.32 | 95.15 |
| pHsau | 6.72 | 6.72 | 6.76 | 6.74 | 6.66 | 6.58 |
Nhận xét: Với những điều kiện số liệu thưc nghiệm ở trên thì liều lượng chất trợ keo tụ sử dụng trong khoảng 0.06ml đến 0.1ml cho hiệu quả xử lý tối ưu nhất.
TÀI LIỆU THAM KHẢO
[1]. Trần Văn Nhân, Ngô Thị Nga (2005): Giáo trình Công nghệ xử lý nước thải, Nhà xuất bản Khoa học và kỹ thuật.
[2]. Phạm Thị Hồng Phượng: Giáo trình Kỹ thuật nhuộm in hoa, Đại học Công nghiệp TP. Hồ Chí Minh
[3]. Nguyễn Hữu Phú: Giáo trình Hóa lý và hóa keo, Nhà xuất bản Khoa học và kỹ thuật, Hà Nội.
[4]. Nguyễn Thị Thu Thủy (2005): Xử lý nước cấp sinh hoạt và công nghiệp, Nhà xuất bản Khoa Học và kỹ thuật, Hà Nội.
[5]. http://www.hoachatonline.com
[6]. http://www.dost-bentre.gov.vn
[7]. http://www.vietrichem.com.vn
[8]. http://congnghehoahoc.org
[9]. www.hanhtrinhxanh.com.vn



















